Unsere Partner
© ESCCAP Deutschland
Einleitung
1. Individuelle Faktoren: Gesundheitsstatus, Haltung und Lebensumfeld
2. Bekämpfung intestinaler Protozoen
2.1. Giardia Intestinalis
2.2 Tritrichomonas foetus
2.3. Isospora spp.
2.4. Cryptosporidium spp.
2.5. Toxoplasma gondii
2.6. Neospora caninum
2.7. Hammondia spp.
2.8. Sarcocystis spp.
3. Bekämpfung von Parasitenstadien in der Umwelt
4. Prävention zoonotischer Parasitosen
5. Schulung von Praxisteam, Tierbesitzern und Öffentlichkeit
Infektionen von Hunden und Katzen mit intestinalen Protozoen sind in Europa weitverbreitet. Abgesehen von wenigen Ausnahmen scheint es keinerlei Einschränkung hinsichtlich der geografischen Verbreitung zu geben. Die Infektionen werden von Flagellaten (Giardia sp. und Tritrichomonas sp.) und Kokzidien aus dem Unterstamm der Apicomplexa (Isospora spp., Cryptosporidium spp., Toxoplasma sp., Neospora sp., Hammondia spp. und Sarcocystis spp.) verursacht.
Infektionen mit Protozoen haben folgende charakteristische Gemeinsamkeiten:
In dieser Empfehlung werden folgende häufig verbreitete und klinisch relevante Protozoen dargestellt:
Die vorliegende Empfehlung gibt einen Überblick über diese intestinalen Protozoen und deren Bedeutung. Ein wichtiges Anliegen ist, dem Leser praktikable Maßnahmen zur Behandlung und Bekämpfung zu vermitteln, um einer Infektion von anderen Tieren und Menschen vorzubeugen.
Maßnahmen zur Bekämpfung von Protozoen müssen individuell an die Patienten angepasst werden. Bestimmte Faktoren erfordern intensivere Maßnahmen, während sich bei anderen ein weniger inten- sives Vorgehen rechtfertigen lässt. Folgende Aspekte sind zu berücksichtigen:
Tier
Das Risiko einer Erkrankung infolge von Protozoen-Infektionen ist für Hunde- und Katzenwelpen höher als für ältere Tiere. Adulte Tiere (insb. Zuchttiere) können eine permanente/wiederkehrende Infektionsquelle für andere Tiere (insb. Welpen) darstellen, obwohl sie nach einer Infektion häufig eine Immunität entwickeln und selten klinische Symptome zeigen.
Haltung
Die Haltung von mehreren Hunden und Katzen in enger Gemeinschaft (Zwinger, Tierheim, Tierpension) erhöht das Risiko von Protozoen-Infektionen, die direkt übertragen werden, wie z. B. Giardia intestinalis, Tritrichomonas foetus, Cryptosporidium spp. oder Isospora spp. Der Freigang von Katzen ist ein weiterer Risikofaktor.
Ernährung
Hunde und Katzen, die mit rohem Fleisch und Innereien ernährt werden (z. B. beim BARFen) und/ oder Wildnager fressen, mit Fötus- oder Plazentamaterial in Kontakt kommen können, unterliegen einem erhöhten Infektionsrisiko für zystenbildende Kokzidien, wie Neospora caninum, Hammondia spp., Toxoplasma gondi, Isospora spp. oder Sarcocystis spp.
Lebensraum und Reisen
Die aufgeführten Protozoen sind europaweit verbreitet. Reisen ins europäische Ausland bergen daher grundsätzlich kein erhöhtes Infektionsrisiko.
Giardia intestinalis (syn. G. duodenalis, G. lamblia) kommt bei einer Vielzahl von Wirbeltieren vor. Es treten mehrere Genotypen (A-G) mit unterschiedlichen Wirtsspektren auf.
Lebenszyklus
Der Entwicklungszyklus von G. intestinalis ist homoxen. Trophozoiten besiedeln den Dünndarm, vermehren sich durch wiederholte Zweiteilung und bilden widerstandsfähige Zysten, die mit dem Kot in die Umwelt gelangen. Die Anzahl der ausgeschiedenen Zysten ist häufig sehr groß. Die Infektion erfolgt oral durch die Aufnahme von Zysten. Nach einer Infektion heften sich die Trophozoiten an die Schleimhautepithelzellen. Die Präpatenz beträgt 4-16 Tage. Zysten sind unmittelbar infektiös und können intermittierend über mehrere Wochen oder Monate ausgeschieden werden (Patenz).
Epidemiologie/Vorkommen
Giardia-Infektionen zählen bei Jungtieren < 1 Jahr zu den häufigsten Endoparasitosen. Die Prävalenz liegt deutlich über der älterer Hunde und Katzen. Zysten werden von Tieren mit klinischen Symptomen, aber auch bei inapparentem Verlauf ausgeschieden. Eine Infektion induziert eine Teilimmunität, die zu einem milderen Krankheitsverlauf oder in einigen Fällen zu einer vollständigen Eliminierung des Erregers führen kann. Diese partielle Immunität kann Reinfektionen aber nicht sicher verhindern. Die Übertragung von Giardien erfolgt oral als Schmutz- oder Schmierinfektion sowie durch fäkal kontaminiertes Wasser und Futtermittel. Die minimale infektiöse Dosis beträgt nur wenige Zysten. Die Zysten bleiben in feuchter Umgebung mindestens 3 Monate und im Kot rund 1 Woche infektiös, sind aber gegenüber Austrocknung und kalten Temperaturen (-4 °C über eine Woche) empfindlich. Wildtiere und andere Tiere können ebenfalls befallen sein, zoonotische Übertragungen auf den Menschen sind möglich (siehe 2.1.5.).
Die Infektion verläuft häufig inapparent. Klinisch auffällig ist sie vor allem bei Hunde- oder Katzenwelpen sowie bei immunsupprimierten Tieren, besonders bei gleichzeitiger Infektion mit anderen Erregern. Die Beschwerden äußern sich in chronisch intermittierenden Durchfällen mit dünnbreiiger bis wässriger Kotkonsistenz und Schleimhautbeimengungen. Weitere Symptome sind Inappetenz, Vomitus, Gewichtsverlust und Apathie.
Giardia-Infektion verlaufen häufig über lange Zeit asymptomatisch, insbesondere bei erwachsenen Tieren. Zur Diagnose eines Giardia-Befalls ausgehend von Kotproben stehen mehrere Methoden zur Verfügung:
Therapie und Bekämpfung
Ob eine Therapie eines Giardia-befallenen Tieres sinnvoll ist oder nicht hängt von verschiedenen Faktoren ab. Eine Behandlung ist bei Vorliegen gastrointestinaler Symptome angezeigt, dabei soll eine kohlenhydratarme Ernährung die Therapie begünstigen. Die Behandlung einer Giardiose ist in manchen Fällen von variablem oder unsicherem Erfolg, so dass die Infektion trotz Therapie bestehen bleiben kann. Häufig kommt es aber auch unmittelbar nach einer Behandlung zur Reinfektion. Daher ist ein Hinweis an den Tierhalter, dass Rezidive möglich oder sogar wahrscheinlich sind, angebracht.
Schlussfolgernd bedeutet dies, dass die Chemotherapie nicht die Elimination der Erreger sichert. Außerdem wird nicht generell empfohlen, klinisch unauffällige Giardia-Träger zu behandeln. Grundsätzlich kann jedoch das Risiko einer zoonotischen Übertragung, besonders bei Anwesenheit von Risikopatienten (Kleinkinder, immunkompromittierte Menschen), oder das Risiko einer Ansteckung anderer Tiere (in Hundezuchten oder in Tierheimen) als Therapiegrund gelten.
In Deutschland sind für die Behandlung der Giardiose bei Hunden und Katzen Tierarzneimittel zugelassen die entweder den Wirkstoff Fenbendazol oder Metronidazol enthalten.
Dosierung von Fenbendazol für die Behandlung der Giardiose bei Hunden und Katzen:
1 x täglich 50 mg/kg KG p. o. über 3 Tage. Diese Behandlung stellt sich in der Praxis jedoch häufig als nicht ausreichend dar, so dass von vorne herein eine 5-tägige Behandlung empfohlen wird.
Dosierung von Metronidazol für die Behandlung der Giardiose bei Hunden und Katzen:
2 x täglich 25 mg/kg KG p. o. über 5-7 Tage.
Auch Kombinationspräparate mit Febantel/Pyrantel/Praziquantel (Umwidmung der Indikation, Dosierung: bei Hunden 1 x täglich Febantel 15 mg/kg KG, Pyrantel 14,4 mg/kg KG und Praziquantel 5 mg/kg KG über 3 Tage; für Katzen doppelte Dosis über 5 Tage) sind wirksam. Außerdem liegen Berichte über die erfolgreiche Anwendung von Ronidazol (2 x täglich 30-50 mg/kg KG über 7 Tage) bei Hunden vor (für Katzen kann die Dosierung für Tritrichomonas foetus von 30 mg/kg KM täglich für 14 Tage angewendet werden). Eine diesbezügliche Umwidmung ist allerdings lediglich bei zuvor nachgewiesenem Therapieversagen der zugelassenen Präparate bzw. Wirkstoffe zulässig.
Eine Therapiekontrolle sollte mit einer der unter 2.1.3 angeführten Methoden etwa 5-7 Tage nach Behandlungsende erfolgen. Bei positivem Befund UND fortbestehender Klinik ist die Behandlung entsprechend zu wiederholen.
Begleitend zur Behandlung sind Maßnahmen zur Verminderung der Kontamination der Umwelt mit Giardia-Zysten (s.u.) durchzuführen bzw. bei ausbleibendem Behandlungserfolg zu intensivieren. Denn: Maßnahmen, die den Infektionsdruck reduzieren, sind für den Erfolg der Therapie oftmals entscheidend. Unterstützend wirkt das Shampoonieren der Hunde zu Beginn und Ende der Behandlung (z. B. mit einem chlorhexidindigluconathaltigen Shampoo).
Sinnvolle Maßnahmen zur Verhinderung der Übertragung auf andere Tiere und zur Prophylaxe einer Reinfektion sind:
In Tierheimen/Zuchten/Zwingern sind folgende Maßnahmen zusätzlich sinnvoll:
Die meisten Genotypen, die bei Hunden und Katzen vorkommen, sind keine Zoonoseerreger. Nur zu einem geringen Prozentsatz werden bei Tieren zoonotisch relevante Genotypen nachgewiesen. Mit den in der Praxis üblichen Nachweisverfahren werden die verschiedenen Genotypen jedoch nicht differenziert und identifiziert. Zoonotisch relevante Genotypen können bei Bedarf jedoch mit molekularbiologischen Methoden ermittelt werden. Immunsupprimierte Personen sind besonders gefährdet und sollten bei Auftreten von Magen-Darm-Symptomen einen Humanmediziner aufsuchen.
Arten
Bei den Trichomonaden ist Tritrichomonas foetus für die Kleintierpraxis relevant. T. foetus tritt als Durchfallerreger bei Katzen und anderen Feliden auf. Bei Hunden wurde der Erreger nur vereinzelt nachgewiesen. Für eine Verbindung der Erregerreservoire von latent infizierten Katzen und Rindern liegen keinerlei Hinweise vor.
Lebenszyklus
Der Entwicklungszyklus ist homoxen. T. foetus vermehrt sich durch Zweiteilung der Trophozoiten im Dünn- und Dickdarm ohne Zystenbildung. Die Präpatenz beträgt ca. 2 Wochen. Die Infektion besteht oft über mehrere Wochen oder Monate.
Epidemiologie/Vorkommen
Bei T. foetus gibt es keine infektiösen Dauerstadien in der Umwelt. Übertragung und Infektion erfolgen vielmehr als Schmierinfektion von Katze zu Katze bzw. bei Kontakt zum Kot infizierter Tiere. Trotz weniger Daten zur Prävalenz der Infektion bei Katzen kann von einer ziemlich geringen Prävalenz ausgegangen werden. In größeren Gruppen wie z. B. Zuchten, Katzenpensionen oder Tierheimen kann die Anzahl infizierter Tiere höher sein.
Infektionen mit T. foetus verlaufen häufig inapparent und asymptomatisch. Dies erklärt auch die Anzahl nicht erkannter, asymptomatischer Ausscheider. Klinische Symptome treten vorwiegend bei Katzenwelpen oder Jungkatzen auf. Sie äußern sich durch breiige, kuhfladenähnliche Durchfälle mit Blut- und/oder Schleimhautbeimengungen, Kotinkontinenz, Hautreizungen und Schmerzen um den Anus.
Der direkte Erregernachweis mittels PCR-Untersuchung von Kot ist Methode der Wahl und kann gleichzeitig zur Speziesbestimmung eingesetzt werden.
Möglich ist auch ein Nachweis nach kultureller Anreicherung. Hierfür eignen sich kommerziell erhältliche Testsysteme, wie z. B. InPouch®TF-Kultur 56 % (BioMed Diagnostics), in denen sich Pentatrichomonas hominis und Giardien nicht vermehren.
Letztlich können die birnenförmigen Trophozoiten (10-25 x 3-15 μm) auch direkt im feuchten Kot nachgewiesen werden. Die Sensitivität des Nachweises ist aber gering. Während Giardien eine träge Bewegung aufweisen, zeichnen sich die Trophozoiten von T. foetus durch schnelle, ruckartige Bewegungen und eine undulierende Membran aus. Der Erreger muss ferner von dem Kommensalen P. hominis, der gelegentlich bei Katzen und Hunden nachgewiesen werden kann, sowie von anderen Trichomonaden unterschieden werden.
Um die Sensitivität jeglicher Diagnostik zu erhöhen, sollten aufgrund der intermittierenden Ausscheidung drei Kotproben über einen Zeitraum von 3-5 Tagen untersucht werden.
Therapie
Es gibt keine für die Katze zugelassenen Wirkstoffe zur Behandlung von T. foetus. Über den Einsatz von Ronidazol mit unterschiedlichem Erfolg wurde berichtet (Umwidmung). Basierend auf aktuellen Daten ist die momentane Empfehlung für die Therapie von T. foetus eine Dosierung von 30 mg/kg Körpergewicht einmal täglich über 14 Tage. Aufgrund der neurotoxischen Komponente des Wirkstoffes, die zu Apathie, Ataxie und Krämpfen führen kann, ist während des Behandlungszeitraumes eine strenge Überwachung der Katze indiziert. Die neurotoxische Symptomatik scheint bei Therapieabbruch reversibel zu sein. Der Einsatz von Metronidazol und Fenbendazol führt nur zu kurzzeitiger Besserung und ist nicht empfehlenswert.
2 Wochen sowie 20 Wochen nach Ende der Therapie wird jeweils eine Kontrolle mittels PCR-Untersuchung empfohlen. Sinn dieser Maßnahmen ist es, asymptomatische Ausscheider zu identifizieren und gegebenenfalls von anderen Tieren zu separieren sowie verstärkte Hygienemaßnahmen zu ergreifen.
Hinweis für Gruppenhaltung/Tierheime/Pensionen/Zuchten
Reinfektionen mit T. foetus sind ein häufiges Problem in Tierheimen, größeren Katzenzuchten und Tierpensionen. Sobald bei einem Tier eine Infektion nachgewiesen wird, muss dieses behandelt und von der Gruppe isoliert werden. Darüber hinaus müssen sämtliche Katzen der Gruppe getestet und bei positivem Ergebnis behandelt und isoliert werden. Die pauschale Behandlung aller Katzen mit Ronidazol unabhängig von einem Test, ist bedenklich, da trächtige und säugende Kätzinnen sowie sehr junge Katzen nicht mit Ronidazol behandelt werden sollten. Ferner steigt das Risiko, dass Nebenwirkungen zum Tragen kommen, statistisch mit zunehmender Anzahl behandelter Katzen. Werden allerdings nur die Katzen mit Diarrhö oder bestätigter Infektion behandelt, ist dies im Allgemeinen ineffektiv, wenn die betroffenen Tiere nicht aus der Gruppe genommen und isoliert werden.
Prävention
Die Manifestation klinischer Symptome steht oft in direktem Zusammenhang mit der Haltungsform (hohe Tierzahl und/oder Besatzdichte). Quelle für Reinfektionen können bereits wenige chronische bzw. therapieresistente Fälle sowie asymptomatische Ausscheider sein.
Sinnvolle Maßnahmen zur Verhinderung der Übertragung auf andere Tiere und zur Prophylaxe einer Reinfektion sind:
T. foetus hat keine zoonotische Bedeutung.
Arten
Die Arten der zur Gattung Isospora gehörenden Kokzidien sind streng wirtsspezifisch. Beim Hund sind 3 Arten bekannt: I. canis, I. ohioensis und I. burrowsi. I. ohioensis und I. burrowsi sind morphologisch nur schwer zu differenzieren, sodass sie häufig als I.–ohioensis-Komplex bezeichnet werden. Bei der Katze parasitieren I. felis und I. rivolta.
Lebenszyklus
Tiere infizieren sich im Allgemeinen direkt durch Aufnahme sporulierter Oozysten aus der Umwelt. Der Erreger vermehrt sich in den Zellen der Dünn- und Dickdarmschleimhaut. Nach einer Präpatenz von 6-10 Tagen gelangen die unsporulierten Oozysten mit dem Kot in die Außenwelt und entwickeln sich innerhalb weniger Tage zu sporulierten, infektiösen Stadien. Die Ausscheidung der Oozysten mit dem Kot (Patenz) variiert meist zwischen 1 und 4 Wochen.
Nagetiere, Wiederkäuer und einige andere Tierarten können als paratenische Wirte in den Entwicklungszyklus involviert sein. Nach Aufnahme sporulierter Oozysten bilden sich bei diesen Wirten in verschiedenen Organen intrazelluläre Ruhestadien (Dormozoiten), die in den paratenischen Wirten mindestens 2 Jahre infektiös bleiben und ihre Entwicklung erst fortsetzen, wenn sie mit dem Beutetier von Hund oder Katze aufgenommen werden. Nach Aufnahme von Dormozoiten kann die Präpatenz verkürzt sein.
Epidemiologie/Vorkommen
Isospora-Arten von Hund und Katze sind weltweit verbreitet. Oozysten sind im Kot klinisch erkrankter und subklinisch infizierter Tiere nachzuweisen. Zur Erstinfektion kommt es meist während der Saugphase im Alter von 3-8 Lebenswochen. Folglich tritt die überwiegende Anzahl klinischer Fälle bei Hunde- und Katzenwelpen < 4 Monaten auf. Ältere Tiere infizieren sich meist durch Aufnahme infektiöser Oozysten aus der Umwelt, die in der Außenwelt mehrere Monate infektiös sind und vermehrt in Haltungsformen mit hoher Tierzahl und/oder Besatzdichte auftreten. Auch eine Infektion über die Fütterung von rohem Fleisch (z. B. beim BARFen), das zuvor nicht ausreichend eingefroren oder erhitzt wurde, ist möglich. Nach Reinfektion scheiden die Tiere im Allgemeinen nur wenige Oozysten aus und sind klinisch inapparent.
I. canis und I. felis verursachen bei Hunden- und Katzenwelpen Durchfälle, die in schweren Fällen blutig sein können und gelegentlich zum Tod führen. Klinische Symptome und Erkrankungen sind häufig mit viralen, bakteriellen oder helminthologischen Begleitinfektionen vergesellschaftet. Bei einer Futterumstellung (z. B. bei Jungtieren von Milch auf Festnahrung) kann möglicherweise vermehrt Diarrhö als Symptom auftreten. Wie bei vielen Kokzidien-Infektionen tritt Durchfall meist kurz vor Beginn der Oozysten-Ausscheidung auf. Es gibt aber, vor allem bei älteren Tieren, auch sehr viele symptomlose Ausscheider.
Der Nachweis von Oozysten erfolgt in einer Kotuntersuchung im Flotationsverfahren. Die Morphologie der verschiedenen Isospora-Oozysten wird in Tabelle 1 beschrieben.
Tabelle 1: Charakteristika der Oozysten verschiedener Kokzidien
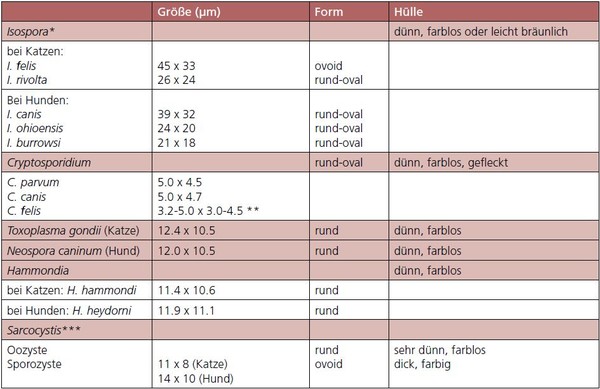
* In frischem Kot enthalten die Oozysten von Isospora spp. einen großen Sporont, in älteren Kotproben (> 12 Stunden) können zwei runde Sporozysten gesehen werden.
** Hierzu liegen unterschiedliche Informationen vor.
*** Verschiedene Arten mit morphologisch nicht zu differenzierenden Sporozysten bei Hunden und Katzen; sehr dünnwandige Oozysten, Ruptur während der Darmpassage und Freisetzung zweier vollständig sporulierter Sporozysten.
Therapie und Prävention
In einem Wurf unterliegen die Geschwister eines mit Isospora spp. infizierten Welpen einem hohen Infektionsdruck, auch dann, wenn sie selber noch keine Oozysten ausscheiden. Eine Behandlung im frühen Infektionsstadium ist daher wichtig, um eine rasante Vermehrung pathogener intestinaler Stadien mit der Produktion und Ausscheidung zahlreicher Oozysten zu unterbinden. Empfohlen ist die Behandlung aller empfänglichen Tiere, die mit dem infizierten Tier Kontakt hatten/haben.
Für Hunde ist ein Kombinationspräparat aus Toltrazuril und Emodepsid zur Behandlung von Mischinfektionen aus Kokzidien und Nematoden zugelassen. Eine Umwidmung für Katzen kann bei entsprechender Indikation vorgenommen werden. Die empfohlene Dosierung bei Hunden ist 9 mg Toltrazuril/ kg KGW, bei Katzen 18 mg Toltrazuril/kg KGW.
Eine einmalige Gabe von Toltrazuril reduziert die Oozysten-Ausscheidung erheblich. Wird sie noch während der Präpatenz verabreicht, wird die Oozysten-Ausscheidung noch weiter vermindert und der durch die Infektion verursachte Durchfall weitgehend vermieden. In Zuchten/Beständen mit wiederkehrenden Ausbrüchen klinischer Erkrankungen durch Isospora-Infektionen sollte jeder Wurf je 1 x in der 3., 5. und 7. Lebenswoche behandelt werden, um die Infektion zu kontrollieren und stufenweise zu reduzieren. Alle Hunde in der Gruppe sollten gleichzeitig behandelt werden. In sehr seltenen Fällen können auch erwachsene Tiere, ohne klinische Symptome zu zeigen, Oozysten ausscheiden. Es bleibt daher eine Frage des Ermessens, ob auch ältere Tiere mitbehandelt werden. Um den Behandlungserfolg zu überprüfen, empfiehlt sich eine Diagnostik mittels Kotuntersuchung im Flotationsverfahren, da damit der Grad der Oozystenausscheidung festgestellt werden kann.
Wichtig: Ist aus außerordentlichen Gründen eine Umwidmung von Toltrazuril-Präparaten vom Nutztier auf Hund oder Katze notwendig, dürfen stets nur orale Präparate für Wirbeltiere angewendet werden, niemals jedoch eine Lösung zur Gabe über das Trinkwasser beim Geflügel, da Geflügel-Formulierungen bei Säugern stark ätzend auf Schleimhäute wirken.
Toltrazuril ist wirksam gegen die Vermehrung von Kokzidien und verhindert die Oozysten-Ausscheidung. Klinische Symptome, die durch Schädigung der Darmschleimhaut bereits vor der Behandlung entstanden sind (z. B. Durchfall), kann die Behandlung mit Toltrazuril nicht beseitigen. In diesen Fällen können unterstützende Behandlungsmaßnahmen angezeigt sein.
Ziel der Behandlung gegen Isospora ist es, die Oozysten-Ausscheidung in die Umwelt zu minimieren und dadurch das Risiko einer Reinfektion und Infektion anderer empfänglicher Tiere zu verringern. Neben der Gabe von Toltrazuril ist es wichtig, Hygienemaßnahmen durchzuführen:
Isospora spp. hat keine zoonotische Bedeutung.
Arten
Bei Hunden und Katzen wurden drei Cryptosporidium-Arten beschrieben: C. parvum, C. canis und C. felis, die nur molekularbiologisch zu differenzieren sind, da die Oozysten sehr klein (ca. 5 μm) und morphologisch nicht zu unterscheiden sind.
Lebenszyklus
Die Infektion erfolgt durch orale Aufnahme von Cryptosporidium-Oozysten. Nach Vermehrung im Darm werden 2-14 Tage nach Infektion unmittelbar infektiöse Stadien mit dem Kot ausgeschieden.
Epidemiologie/Vorkommen
Cryptosporidium-Oozysten sind in der Außenwelt lange infektiös und werden nur von wenigen Desinfektionsmitteln abgetötet. Die aktuelle Desinfektionsmittelliste der Deutschen Veterinärmedizinischen Gesellschaft (DVG) mit entsprechend empfohlenen Desinfektionsmitteln kann angefordert werden unter www.dvg.net.
Bei immunkompetenten adulten Tieren verläuft die Infektion meist asymptomatisch. Katzen- und selten auch Hundewelpen können an wässriger, manchmal faulig riechender Diarrhö erkranken, unter der sie einige Tage oder gelegentlich auch Wochen leiden. Der Durchfall setzt häufig einige Tage nach Beginn der Oozysten-Ausscheidung ein. Weitere Symptome sind Abdominalschmerzen, Vomitus und erhöhte Körpertemperatur. In den meisten Fällen kommt es zu einer spontanen Heilung.
Mittel der Wahl zur Diagnose sind kommerziell erhältliche Tests zum Nachweis von Kopro-Antigen, die auch bei geringer Oozysten-Ausscheidung geeignet sind. Darüber können Cryptosporidium-Oozysten in Kotausstrichen mithilfe besonderer Färbemethoden (Ziehl-Neelsen, Safranin/Heine = Negativfärbung) als kleine, runde, durchsichtige, pinke oder orange Stadien mikroskopisch nachgewiesen werden. Die Morphologie der verschiedenen Cryptosporidium-Oozysten wird in Tabelle 1 beschrieben.
Therapie und Prävention
Für eine Behandlung der Cryptosporidiose stehen für Hunde und Katzen keine zugelassenen oder als wirksam beschriebenen Wirkstoffe zur Verfügung. Da die Infektion in den meisten Fällen spontan abheilt, steht eine symptomatische Behandlung im Vordergrund (Flüssigkeitsersatz, Spasmolytika).
Cryptosporidium-Oozysten haben eine hohe Widerstandsfähigkeit, sodass strenge hygienische Maßnahmen empfohlen werden, um das Infektionsrisiko zu reduzieren. Empfohlen sind folgende Maßnahmen:
Bei C. parvum besteht ein zoonotisches Risiko. Eine Infektionsgefahr mit C. canis und C. felis besteht hingegen in der Regel nur für immunsupprimierte Personen.
Arten
Die Gattung Toxoplasma enthält als einzige Art Toxoplasma gondii, die sich weltweit in mindestens drei Genotypen mit verschiedenen Mischformen einteilen lässt. Endwirte sind ausschließlich Katzen und einige wildlebende Feliden. In seltenen Fällen fungiert der Hund als Zwischenwirt, wobei es bei diesem jedoch nur zur Entwicklung extraintestinaler Stadien ohne Ausscheidung von Oozysten kommt. Zwischenwirte sind vermutlich alle warmblütigen Tiere und Menschen.
Lebenszyklus
Toxoplasma gondii tritt in drei Formen auf:
Infektionsmöglichkeiten für Katze/Hund:
Ausschließlich bei Katzen (Endwirt) kommt es zu einer fäkalen Ausscheidung von Toxoplasma-Oozysten. Eine erstmalige Infektion resultiert bei ihnen 18-36 Tage (Präpatenz) später in einer ca. 3 Wochen andauernden Oozystenausscheidung, deren Maximum in der ersten Woche liegt. Anschließende Infektionen verlaufen in der Regel ohne erneute Oozystenausscheidung.
Epidemiologie/Vorkommen
In einer in Deutschland durchgeführten Querschnittsstudie wurde bei weniger als 1 % der Katzen eine fäkale Ausscheidung von Toxoplasma-Oozysten festgestellt. Katzen können für einige Tage eine große Menge Oozysten ausscheiden. Danach scheiden sie, sofern sie nicht immungeschwächt sind, selbst nach einer Reinfektion meist nur noch wenige oder gar keine Oozysten mehr aus. Aufgrund der hohen Tenazität der Oozysten und der Bedeutung der Zwischenwirte lässt sich die weite Verbreitung von T. gondii dennoch erklären.
Die kleinen Oozysten verbreiten sich leicht und können in feuchtem Milieu mehrere Monate infektiös bleiben. Mit Toxoplasma-Oozysten kontaminiertes Wasser ist ebenso wie kontaminierte feuchte Erde und Futterpflanzen eine wichtige Infektionsquelle für pflanzenfressende Zwischenwirte. Fleischfressende Zwischenwirte infizieren sich hingegen häufig durch die Aufnahme von Zysten aus dem Gewebe anderer infizierter Zwischenwirte. Kleinnager haben als Reservoirwirte von T. gondii epidemiologisch vermutlich keine wesentliche Bedeutung.
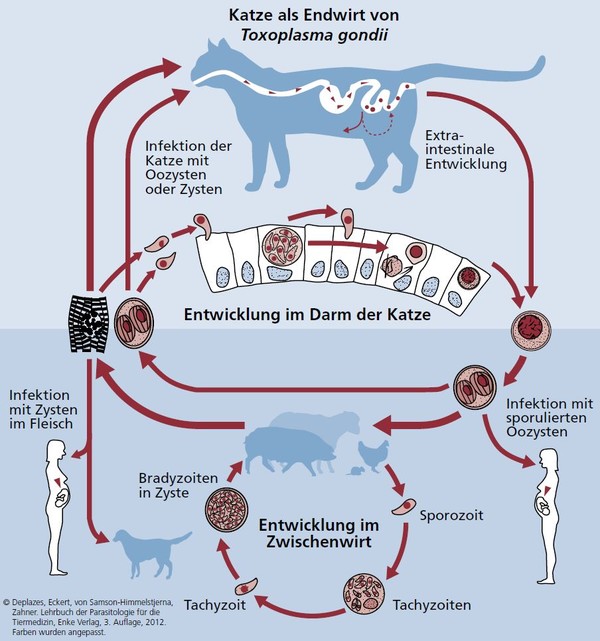
Abb. 1: Entwicklungszyklus von Toxoplasma gondii
Für die tierärztliche Praxis ist es wichtig, zu unterscheiden zwischen:
Katzen mit einer akuten Infektion (systemische Toxoplasmose):
Katzen als Endwirte (intestinale Toxoplasmose):
Die Diagnose basiert auf der klinischen Symptomatik und dem Nachweis spezifischer Antikörper im Serum. Bei Katzen mit inapparenter Infektion sind Antikörpertiter häufig, aber nicht immer nachzuweisen, sodass die Untersuchung nur im positiven Fall aussagekräftig ist. Während der akuten Infektionsphase kann der Erregernachweis lediglich durch Untersuchung von Liquor- oder Gewebeproben erreicht werden.
Bei Hunden wird eine klinisch manifeste Toxoplasmose serologisch nachgewiesen und zusätzlich mittels PCR (Liquor) gesichert.
Der Nachweis von Oozysten im Kot der Katze gelingt mit dem Flotationsverfahren nur sehr selten, da die Hauptausscheidungsphase sehr kurz ist und anschließend intermittierend und nur unter noch unbekannten Umständen (Reshedding) Oozysten ausgeschieden werden. Die Oozysten sind morphologisch außerdem identisch mit denen von Hammondia hammondi (siehe Tabelle 1).
In der Praxis ist eine Diagnose oft dann gefragt, wenn Besitzer wissen wollen, ob von dem Tier aktuell eine Gefahr für den Menschen ausgeht. Das Untersuchungsschema sowie die Interpretation serologischer und koproskopischer Ergebnisse sehen folgendermaßen aus und skizzieren drei Risikofälle:
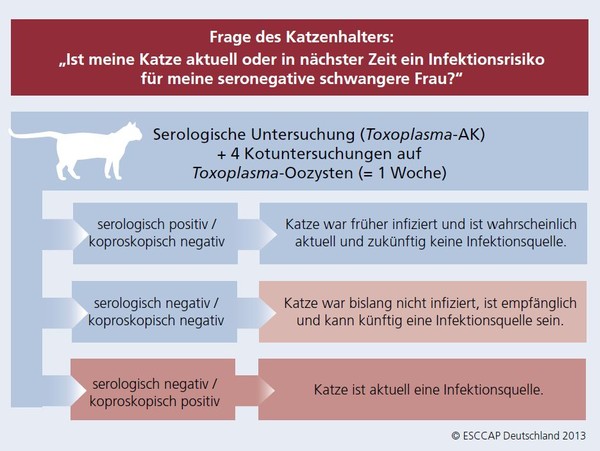
Abb. 2: Toxoplasma gondii – Diagnostisches Verfahren
Prophylaxe
Wichtigstes Ziel ist es, das Infektionsrisiko des Menschen durch eine Einschränkung der Oozysten-Ausscheidung zu senken.
Therapie
Katzen und Hunde mit einer akuten Infektion (systemische Toxoplasmose):
Katzen als Endwirte (intestinale Toxoplasmose):
Toxoplasmose ist weltweit eine der bedeutendsten parasitären Zoonosen. Das Risiko eines immunkompetenten Erwachsenen nach einer Infektion mit T. gondii an einer schweren Toxoplasmose zu erkranken ist gering. Jedoch können immungeschwächte Personen und intrauterin infizierte Kinder an einer schweren, bisweilen letal verlaufenden Toxoplasmose erkranken. Diese kann lokal begrenzt sein (im Allgemeinen: Auge oder Gehirn) oder generalisiert verlaufen. Pränatale Infektionen treten dann auf, wenn sich schwangere Frauen während der Schwangerschaft erstmalig mit T. gondii infizieren.
Infektionsmöglichkeiten für den Menschen:
Wichtig:
Für schwangere Frauen, bei denen vor der Schwangerschaft keine Infektion mit Toxoplasmen erfolgt ist, sowie für Personen mit hohem Erkrankungsrisiko, z. B. immunsupprimierte Personen werden folgende Maßnahmen empfohlen:
Schutz vor Infektion durch Zysten:
Schutz vor Infektion durch Oozysten:
Arten
In der Gattung Neospora ist für die Kleintierpraxis Neospora caninum von Interesse. Für Neospora caninum ist der Hund als End- und Zwischenwirt beschrieben. Möglicherweise kommen auch andere wildlebende Kaniden, wie der Wolf, als Endwirte in Betracht. Als Zwischenwirte dienen außerdem Rinder, Schafe, Ziegen und Huftiere.
Lebenszyklus
Hunde infizieren sich meistens durch Aufnahme bradyzoitenhaltiger Zysten aus dem Gewebe infizierter Zwischenwirte (vorwiegend Rind). Die Präpatenz beträgt bei natürlichen Infektionen 5-9 Tage, die Patenz im Allgemeinen 11-20 Tage. Die Oozysten sind für Zwischenwirte erst 1-3 Tage nach der Ausscheidung infektiös. Bei chronisch mit dem Erreger infizierten, trächtigen Milchkühen kann es darüber hinaus wiederholt auch zu einer intrauterinen Übertragung des Parasiten auf die Föten kommen.
Epidemiologie/Vorkommen
Untersuchungen zeigen, dass sich die meisten Hunde postnatal infizieren. Die Infektion tritt bei älteren Hunden häufiger auf als bei jungen. Die Tiere infizieren sich meist durch Aufnahme von infiziertem Abortmaterial vom Rind oder von rohem, erregerhaltigem Rindfleisch (z.B. beim BARFen). Eine intrauterine Übertragung erfolgt vermutlich erst gegen Ende der Trächtigkeit.
Oozysten von N. caninum können im Kot infizierter Hunde nachgewiesen werden. Die Anzahl an Oozysten variiert von sehr wenigen bis zu > 100.000 Oozysten/g Kot. N. caninum gilt als Hauptverursacher von Aborten beim Rind. Aktuelle Studien belegen aber, dass der Hund als Überträger via Kontamination von Weiden und Futter praktisch keine Rolle spielt.
Für die tierärztliche Praxis ist es wichtig, zu unterscheiden zwischen:
Hunde mit einer akuten Infektion (systemische Neosporose):
Hunde als Endwirte (intestinale Neosporose):
Die Diagnose basiert auf der klinischen Symptomatik und dem Nachweis spezifischer Antikörper im Serum (ELISA, IFAT). Bei Hunden mit inapparenter Infektion sind Antikörpertiter häufig, aber nicht immer nachzuweisen, sodass die Untersuchung nur im positiven Fall aussagekräftig ist. Welpen werden im Allgemeinen 2-3 Wochen nach der Infektion serologisch positiv.
Der Verdacht aufgrund klinischer Symptome kann auch durch eine PCR-Untersuchung (Liquor, Muskelbiopsie) zum Nachweis von spezifischer DNA durchgeführt werden.
Da die klinischen Erscheinungen durch die Gewebezysten des Parasiten hervorgerufen werden, spielt die Kotuntersuchung diagnostisch keine Rolle. Die Oozysten sind morphologisch außerdem identisch mit denen von Hammondia hammondi und können nur mittels PCR-Untersuchung differenziert werden (siehe Tabelle 1).
Therapie und Prävention
Die Behandlung einer klinisch apparenten Neosporose ist schwierig und nur teilweise erfolgversprechend.
Hunde mit einer akuten Infektion (systemische Neosporose):
Hunde als Endwirte (intestinale Neosporose):
Um einer Verbreitung und Infektionen entgegenzuwirken, werden jedoch folgende Maßnahmen empfohlen:
N. caninum hat keine zoonotische Bedeutung.
Arten
Bei Hunden und Katzen parasitieren zwei jeweils wirtsspezifische Hammondia-Arten: H. heydorni (Hund) und H. hammondi (Katze). Da diese Erreger weder klinisch noch als Zoonoseerreger, sondern lediglich differenzialdiagnostisch (Katze: Toxoplasma, Hund: Neospora) eine Rolle spielen, werden sie hier lediglich kurz behandelt.
Lebenszyklus
Der Entwicklungszyklus von Hammondia spp. gleicht dem anderer zystenbildender Kokzidien-Arten. Hunde und Katzen sind Endwirte und infizieren sich durch Aufnahme von Gewebezysten infizierter Zwischenwirte. Nach einer Präpatenz von 5-13 Tagen (H. hammondi) bzw. 7-17 Tagen (H. heydorni) scheiden infizierte Tiere Oozysten aus. Die Ausscheidungsdauer (Patenz) ist variabel und beträgt maximal 20 Tage. Die Oozysten sporulieren in der Außenwelt zu infektiösen Oozysten. Nach Aufnahme infektiöser Stadien entwickeln sich in der Muskulatur und im Gehirn des Zwischenwirtes (Nager und Wiederkäuer) Gewebezysten.
Epidemiologie/Vorkommen
Hammondia-Oozysten wurden europaweit sporadisch im Katzen- und Hundekot nachgewiesen. Die tatsächliche Prävalenz ist unbekannt, da eine Abgrenzung von Toxoplasma sp. und Neospora sp. nur durch molekularbiologische Untersuchungen möglich ist.
Hammondia-Arten sind für die Endwirte kaum pathogen. Bei Welpen wurden sehr selten Inappetenz und schwere Durchfallerkrankungen beobachtet.
Während der Patenz können kleine Oozysten im Kot nachgewiesen werden (siehe Tabelle 1). Eine Unterscheidung von Toxoplasma-Oozysten (Katze) bzw. Neospora-Oozysten (Hund) ist nur mithilfe von molekularbiologischen Untersuchungen möglich.
Therapie und Prävention
Eine Behandlung ist nicht erforderlich. Lediglich bei sehr selten auftretenden, schweren Durchfällen sollte das Tier mittels Toltrazuril wie beim Vorliegen einer Isosporose (s. 2.3.4) behandelt werden.
Als Prophylaxe wird empfohlen, die Aufnahme von Gewebezysten aus Zwischenwirten durch folgende Maßnahmen zu verhindern:
Hammondia-Arten haben keine zoonotische Bedeutung.
Arten
Hunde und Katzen fungieren bei vielen Arten der Gattung Sarcocystis als Endwirte. Da diese wirtsspezifischen Erreger bei Hunden und Katzen klinisch nicht relevant und auch keine Zoonoseerreger sind, werden sie hier nur kurz abgehandelt.
Lebenszyklus
Hunde und Katzen infizieren sich durch den Verzehr von Sarcocystis-Zysten (sogenannte „Mieschersche Schläuche“) im Muskelfleisch der jeweiligen Zwischenwirte (je nach Sarcocystis-Art sind dies Schaf, Ziege, Schwein, Rind, Hund, Kleinnager). Im Darmepithel von Hund und Katze findet die geschlechtliche Vermehrung statt, die zur Bildung von Oozysten führt, die noch innerhalb der Darmwand sporulieren. Die dünnwandigen Oozysten werden meist noch während der Darmpassage zerstört, sodass vorwiegend infektiöse Sporozysten mit dem Kot ausgeschieden werden. Die Präpatenz beträgt beim Hund 8-33 und bei der Katze 10-14 Tage. Die Ausscheidungsphase (Patenz) kann aufgrund der sehr langsamen Freisetzung der Oozysten aus dem Darmepithel viele Wochen andauern. Die infektiösen Sporozysten werden von den jeweiligen Zwischenwirten oral aufgenommen und entwickeln sich bei diesen letztlich in der quergestreiften Muskulatur zu Gewebezysten.
Epidemiologie/Vorkommen
Sarcocystis spp. sind weltweit verbreitet. Die Erreger haben eine hohe Überlebensrate in der Außenwelt, die Infektiosität bleibt über viele Monate bestehen. In den jeweiligen Zwischenwirtspopulationen sind Sarcocystis-Infektionen weit verbreitet.
Bei Hunden und Katzen verläuft eine Sarcocystis-Infektion unter natürlichen Bedingungen meist inapparent. Die Endwirte entwickeln nach Reinfektion eine artspezifische Teilimmunität.
Klinisch relevant ist die Infektion dagegen bei den Zwischenwirten wie Schafen, Rindern und Schweinen. Bei ihnen kann es nach massiver Aufnahme von Sarcocystis-Sporozysten zu klinischen Symptomen (je nach Sarcocystis-Art z. B. Fieber, Inappetenz, Apathie, ZNS-Störungen, Anämie oder Aborten) kommen. Gewebezysten („Miescherche Schläuche“) im Schlachtkörper können zu fleischbeschaurechtlichen Maßregelungen führen.
Sarcocystis-Sporozysten können mittels gängiger Flotationsverfahren im Kot nachgewiesen werden (siehe Tabelle 1). Da Sporozysten aller Sarcocystis-Arten morphologisch ähnlich sind, ist eine Artdifferenzierung nicht möglich. Andere Nachweisverfahren zur Artdiagnose stehen nicht zur Verfügung.
Therapie und Prävention
Eine Behandlung ist nicht erforderlich.
Als Prophylaxe wird empfohlen, die Aufnahme von Gewebezysten aus Zwischenwirten durch folgende Maßnahmen zu verhindern:
Die bei Hund und Katze nachgewiesenen Sarcocystis-Arten haben keine zoonotische Bedeutung.
Maßnahmen zur Bekämpfung intestinaler Protozoen-Infektionen von Hunden und Katzen wurden bereits in den vorausgegangenen Kapiteln bei den jeweiligen Protozoen beschrieben.
Die wichtigste Voraussetzung zum Schutz vor zoonotischen Erregern – inklusive der intestinalen Protozoen – ist die persönliche Hygiene im Umgang mit Tieren.
Viele Infektionen bleiben unbemerkt, da die in diesen Empfehlungen genannten Erreger häufig weder Hunde und Katzen (vor allem erwachsene Tiere) noch ihre Besitzer klinisch auffällig beeinträchtigen. Glücklicherweise sind die meisten Protozoen, die Hunde oder Katzen befallen, streng artspezifisch. Ausnahmen sind:
Eine strikte persönliche Hygiene ist der einzige Weg, um einer Zoonose vorzubeugen. Bei Personen mit eingeschränkter Immunkompetenz oder Personen, die sich einer immunsupprimierenden Behandlung unterziehen müssen, können auch opportunistische Infektionserreger oder seltene Geno-typen von zoonotisch irrelevanten Parasiten gelegentlich zu Infektionen führen. Bei immungeschwächten Personen können diese Infektionen, wie klassische Zoonoseerreger, zu schweren und sogar tödlich verlaufenden Erkrankungen führen.
Auch innerhalb des veterinärmedizinischen Berufsstandes ist nur wenig über die Infektionen mit intestinalen Protozoen von Hunden und Katzen bekannt. Besonders im Hinblick auf das Zoonoserisiko besteht häufig Unsicherheit.
Die vorliegenden Informationen und Empfehlungen richten sich an alle Personengruppen, die im tiermedizinischen Bereich tätig sind, und fassen die relevanten Fakten zusammen. Ein aktueller Wissensstand über Protozoen-Infektionen ist die unerlässliche Voraussetzung, um ungerechtfertigten Ängsten von Tierbesitzern und der Öffentlichkeit entgegenzuwirken.
Wie bei anderen parasitären, bakteriellen oder viralen Infektionen ist die persönliche Hygiene die effektivste Schutzmaßnahme und sollte daher bei allen Schulungen zu Zoonoserisiken an erster Stelle stehen.
Stand: Januar 2017
Oft erhalten wir bei ESCCAP die Anfrage, wie es sein kann, dass ein Giardienbefall trotz Behandlung nicht in den Griff zu bekommen ist und es immer wieder zu Rezidiven kommt. Dazu folgende Informationen auf den Punkt gebracht:
Die Erfahrung zeigt jedoch, dass trotz dieses konsequenten Vorgehens in manchen Fällen kein Erfolg zu erzielen ist. In diesen Fällen bleibt nur, immer wieder zu behandeln und zu reinigen. Weitere oder effektivere Maßnahmen stehen derzeit nicht zur Verfügung, so dass man unter Umständen mit dem bescheidenen Erfolg leben muss.
© ESCCAP Deutschland
