Unsere Partner
© ESCCAP Deutschland
1. Einleitung
2. Allgemeine Faktoren: Alter, Haltung, Nutzung, Wetter und Klima
3. Spezifische Informationen und Empfehlungen für die Bekämpfung ausgewählter gastrointestinaler Parasiten der Pferde
3.a. Kleine Strongyliden (nicht-migrierende Strongyliden)
3.b. Große Strongyliden (migrierende Strongyliden)
3.c. Spulwürmer (Parascaris equorum und Parascaris univalens)
3.d. Bandwürmer (Anoplocephala perfoliata, Anoplocephala magna und Paranoplocephala mamillana)
3.e. Dasselfliegen (Gasterophilus spp.)
3.f. Zwergfadenwürmer (Strongyloides westeri)
3.g. Pfriemenschwänze (Oxyuris equi)
4. Maßnahmen gegen freilebende Parasitenstadien in der Umwelt
5. Allgemeine Entwurmungsstrategien für Fohlen, Jährlinge, adulte Pferde und Stuten
6. Schulung von Praxisteams, Empfehlungen für Pferdebesitzer
7. Diagnose von Wurmbefall und Antheliminthika-Resistenzen
Als Weidetiere können Pferde sowie andere Equiden von einer großen Zahl unterschiedlicher gastrointestinaler Parasiten befallen werden. Jedes Pferd mit Weidegang ist lebenslang wiederholt Infektionen mit gastrointestinalen Parasiten verschiedener Spezies ausgesetzt. Auch Pferde, die ausschließlich oder vorwiegend im Stall oder auf grasfreien Koppeln gehalten werden, können betroffen sein und von gastrointestinalen Würmern wie Rund- oder Bandwürmern befallen werden. Die Prävention und Bekämpfung parasitärer Infektionen bei Pferden ist deshalb eine dauerhafte Aufgabe für TierärztInnen, LeiterInnen von Pferdebetrieben und PferdebesitzerInnen.
Dank der guten Verfügbarkeit und der häufigen Anwendung von gegen die meisten relevanten gastrointestinalen Parasiten wirksamen sowie gut verträglichen Anthelminthika treten Fälle klinischer Erkrankungen bei Pferden heute sehr viel seltener auf, als dies noch bis vor ca. vier Jahrzehnten der Fall war. Da bislang jedoch keine Parasitenspezies ausgerottet werden konnte und kein protektiver Impfstoff gegen Parasiten von Pferden zur Verfügung steht, sind auch weiterhin routinemäßige Überwachungs- und Bekämpfungsmaßnahmen zum Schutz der Gesundheit der Pferde erforderlich.
Die vollständige Berücksichtigung sämtlicher equiner gastrointestinaler Parasiten würde die Grenzen dieser Empfehlungen sprengen. Daher werden an dieser Stelle lediglich die klinisch relevantesten Parasiten mit den höchsten Prävalenzen in Europa behandelt. Diese sind in Tabelle 1 zusammengefasst.
Ziel dieser Empfehlung ist es, dem Pferdepraktiker/der Pferdepraktikerin kurz gefasste Informationen und praktische Empfehlungen zu den wichtigsten gastrointestinalen Parasiten bei Pferden an die Hand zu geben. Dies wird durch einen aktuellen Überblick über diese Parasiten unter den zurzeit herrschenden epidemiologischen Bedingungen in Europa ergänzt. Der Schwerpunkt dieser Empfehlungen liegt auf der Minimierung von Infektionen mit diesen Parasiten und der entsprechenden klinischen Parasitosen. Die ESCCAP-Empfehlung umfasst Maßnahmen zur Diagnostik und nachhaltigen Prävention (Prophylaxe und Metaphylaxe) unter Berücksichtigung der spezifischen Erfordernisse bei Pferden unterschiedlicher Altersgruppen, Haltungsformen und Nutzungsarten.
Voraussetzung für eine wirksame und nachhaltige Parasitenbekämpfung bei Pferden ist die konsequente Anwendung sämtlicher bekannter präventiver Managementmaßnahmen. Diese sind dem spezifischen Bedarf des jeweiligen Pferdetyps und den jeweiligen Haltungsbedingungen individuell anzupassen.
Einige parasitäre Infektionen, zum Beispiel mit Spulwürmern, führen zu einer partiell protektiven Immunantwort. Ältere Pferde benötigen deshalb zum Schutz vor einer Erkrankung normalerweise keine intensive metaphylaktische Behandlung oder spezifische Haltungsmaßnahmen. Bei Pferden ohne Weidegang ist in der Regel keine starke Exposition gegenüber Strongyliden und Bandwürmer zu erwarten.
Im Rahmen der Beurteilung erforderlicher Bekämpfungsmaßnahmen sollte stets auch berücksichtigt werden, welche Auswirkungen das Klima und das Wetter zum Beispiel auf die
Entwicklung und Epidemiologie von Parasiten, wie z. B. den großen und kleinen Strongyliden, haben können.
(biologische Schlüsselfaktoren, Entwicklungszyklus, Epidemiologie/Prävalenz, klinische Symptome, Diagnose, Arzneimittelbehandlung/Resistenzen)
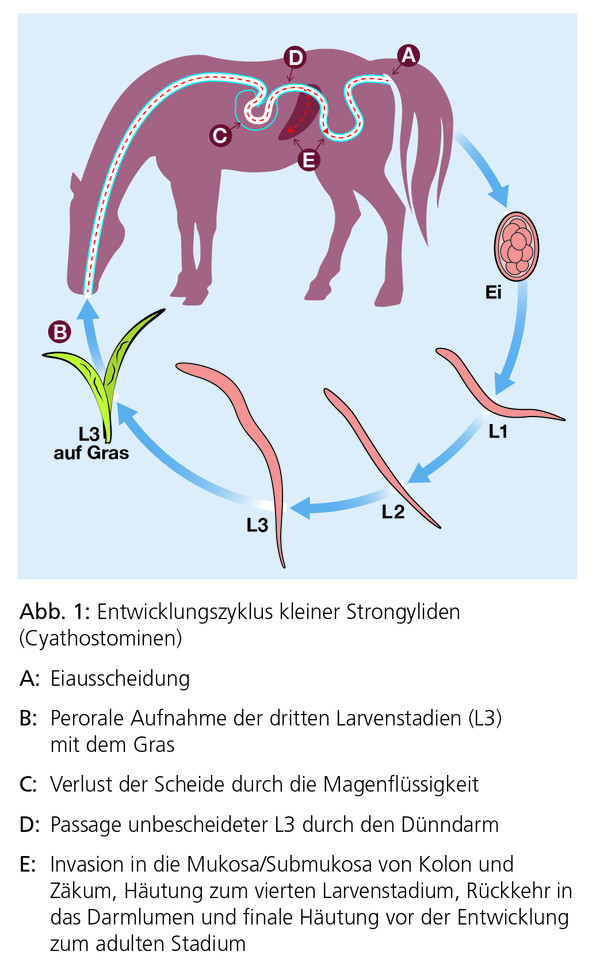
Hierzu gehören die Cyathostominen und andere nicht-migrierende kleine Strongyliden (Triodontophorus spp., Craterostomum spp., Bidentostomum spp. und Oesophagodontus spp.). Infektionen mit kleinen Strongyliden treten in allen europäischen Ländern auf und kommen praktisch in sämtlichen Pferdehaltungen vor. Die Infektion erfolgt hauptsächlich auf
der Weide durch perorale Aufnahme der infektionsfähigen dritten Larvenstadien (L3), die anschließend eine larvale Entwicklung in der Darmschleimhaut durchlaufen, bevor sie wieder in das Darmlumen eintreten (Abb. 1 und Abb. 2). Im Stall erworbene Infektionen sind selten und insgesamt weniger relevant.
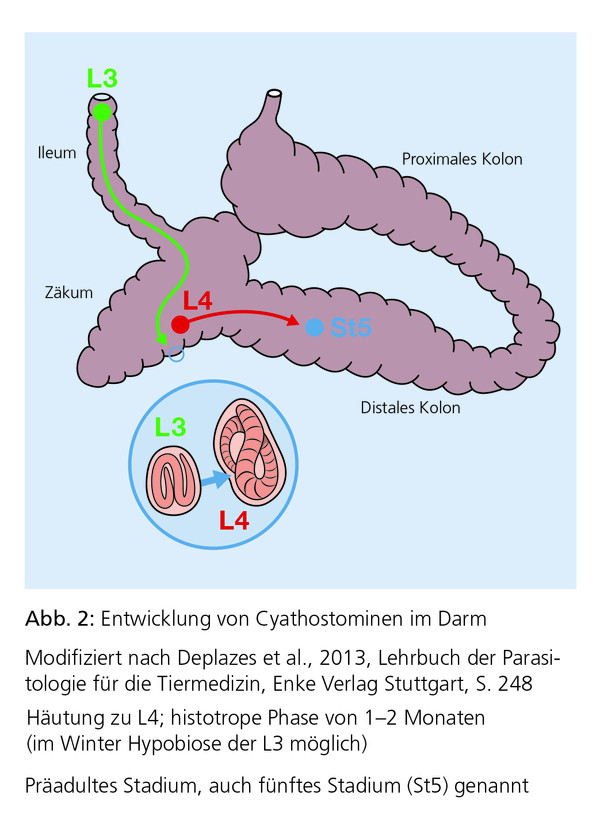
Die kleinen Strongyliden oder auch Cyathostominen (nichtmigrierende Strongyliden) gelten als sehr viel weniger pathogen als große Strongyliden (migrierende Strongyliden) wie z. B. Strongylus-Arten. Bei starkem Befall können Triodontophorus spp. (am häufigsten T. serratus und T. brevicauda) jedoch die Darmschleimhaut schädigen und zu Abmagerung und Diarrhoe führen, da sie dazu neigen, sich im Darm des Pferdes in „Wurmherden“ simultan zu ernähren. Mehr als 40 Cyathostominen-Arten sind bei Pferden bekannt und einzelne Pferde können gleichzeitig von mehreren – oftmals mehr als zehn – Cyathostominen-Arten befallen sein. Cyathostominen können eine larvale Cyathostominose verursachen, eine Folge des synchronen Fortsetzens der Entwicklung zahlreicher inhibierter/enzystierter L3 (Abb. 3) und des simultanen Wiedereintretens großer Zahlen bis dahin in der Schleimhaut verweilender Larvenstadien in das Darmlumen, welches mit massiver Gewebezerstörung einhergeht.

Die Erkrankung wird meist bei Pferden im Alter von bis zu sechs Jahren beobachtet und führt zu akuter und persistierender Diarrhoe (gelegentlich begleitet von Koliken, Gewichtsverlust oder Fieber). In einer beträchtlichen Anzahl von Fällen kommt es zu tödlichen Verläufen. Normalerweise gelten im Darmlumen verweilende larvale und adulte Cyathostomine als nur geringgradig pathogen und die meisten infizierten Tiere scheinen selbst bei relativ hohen Wurmbürden klinisch nicht beeinträchtigt zu sein. Einige Studien erwähnen jedoch eine mögliche Korrelation zwischen einem Cyathostominen-Befall und rezidivierender Diarrhoe und intermittierenden Koliken.
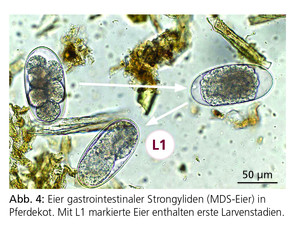
Die Diagnose patenter Infektionen mit kleinen Strongyliden erfolgt mittels Kotprobenuntersuchung über den Nachweis der etwa 60–140 μm langen, dünnschaligen, ovoiden Eier vom Magen-Darm-Strongyliden (MDS)-Typ (Abb. 4).
Oft findet man larvale/präadulte und adulte Stadien in großer Zahl im Kot entwurmter Pferde (Abb. 5).

Für die qualitative oder quantitative Analyse von Strongylideneiern können verschiedene Methoden eingesetzt werden. Wissenschaftliche Daten zur Korrelation zwischen der Anzahl von MDS-Eiern pro Gramm Kot und der intestinalen Wurmbürde bei adulten Pferden liegen bislang aber nicht vor. Eine Studie mit jungen Pferden unter drei Jahren zeigt, dass niedrige MDS-Eizahlen oder sogar negative Kotbefunde bei Pferden mit Tausenden von intestinalen Würmern vorkommen.
Insgesamt kann man bei Pferden in allen Altersgruppen von einer schwachen Korrelation zwischen der MDS-Eizahl und der tatsächlichen intestinalen Wurmbürde ausgehen. Zu beachten ist, dass eine zuverlässige Unterscheidung zwischen Eiern von kleinen (Cyathostominen) und großen Strongyliden (z. B. Strongylus vulgaris) allein aufgrund von morphologischen Kriterien nicht möglich ist. Nach In-vitro-Kultur können die dritten Larvenstadien (L3) kleiner und großer Strongyliden anhand der Anzahl ihrer Mitteldarmzellen differenziert werden. Von Bedeutung ist diese Differenzierung insbesondere wegen der deutlich höheren Pathogenität großer Strongyliden, die heutzutage jedoch Dank der weitverbreiteten Anwendung wirksamer Anthelminthika nur noch in einem geringen Anteil der Pferdehaltungen nachzuweisen sind. Jüngste Daten deuten jedoch darauf hin, dass S. vulgaris in der europäischen Pferdepopulation nach wie vor vorkommt (siehe 4.b.)
Die erstmalige Infektion von Pferden mit kleinen Strongyliden erfolgt mit dem Beginn des Grasens nach dem Weideaustrieb. Die Ausscheidung von Eiern setzt 6–14 Wochen nach der Infektion ein. Geeignete Bekämpfungsmaßnahmen sollten deshalb bereits bei Fohlen ab einem Alter von etwa zwei Monaten eingeleitet werden. In Anbetracht des weitverbreiteten Auftretens von Anthelminthika-Resistenzen (AR) ist es wichtig, die Häufigkeit der Entwurmungen auf ein notwendiges Mindestmaß zu reduzieren, ohne dabei jedoch die Etablierung klinisch relevanter Wurmbürden zu riskieren. Unter den gegenwärtigen epidemiologischen Bedingungen ist in den meisten europäischen Ländern mit einer aktuell lediglich niedrigen bis moderaten Befallsintensität mit kleinen Strongyliden zu rechnen. Daher gilt eine wirksame Behandlung von Fohlen und Jährlingen in dreimonatigen Abständen als angemessen. Bei adulten Pferden kann bereits eine jährlich zweimalige Entwurmung ausreichen. Wenn ein Befall mit großen (migrierenden) Strongyliden ausgeschlossen werden kann, ist eine einzige Entwurmung pro Jahr ausreichend. Voraussetzung ist jedoch, dass die Notwendigkeit häufigerer Entwurmungen durch regelmäßige Kotprobenuntersuchungen ausgeschlossen wird und dass in den betreffenden Pferdehaltungen strikte Quarantänemaßnahmen eingehalten werden.
Pferde mit larvaler Cyathostominose sollten zur Linderung von Diarrhoe (z. B. mit Codeinphosphat) und Schleimhautentzündungen palliativ behandelt werden, bei Bedarf sollte zusätzlich eine Flüssigkeitstherapie erfolgen. In einem betroffenen Bestand sollten unabhängig vom klinischen Status stets alle Pferde aus derselben Altersgruppe mit gegen Schleimhautstadien kleiner Strongyliden wirksamen Präparaten behandelt werden. Zum Einsatz kommt entweder Moxidectin (einmalig oral 0,4 mg/kg Körpergewicht, nur bei Pferden > 4 Monaten) oder Fenbendazol (7,5 mg/kg Körpergewicht oral einmal täglich über fünf Tage, nur wenn die vorhandene Population kleiner Strongyliden gegenüber Benzimidazolen empfindlich ist). Empfohlen werden solche Behandlungen gegen Schleimhautstadien kleiner Strongyliden bei Fohlen und bei jungen Pferden bis zum Alter von einschließlich 4 Jahren einmal jährlich (z. B. am Ende der Weidesaison).
Untersuchungen zum Vorkommen von AR aus Frankreich, Deutschland, Italien und Großbritannien ergaben, dass bei mehr als 80 % aller untersuchten Pferdehaltungen Populationen kleiner Strongyliden mit reduzierter Empfindlichkeit gegenüber Anthelminthika aus der Benzimidazolgruppe (BZs) nachzuweisen waren. Im Falle von Pyrantel wurden Resistenzen bei etwa 20–30 % aller untersuchten Pferdehaltungen festgestellt. Dagegen erwiesen sich die makrozyklischen Laktone (MLs) Ivermectin und Moxidectin als voll wirksam und erreichten 14 Tage nach Entwurmung in nahezu allen getesteten Pferdehaltungen eine MDS-Eizahlreduktion um 95–100 %. Gelegentlich wird nach ML-Behandlung jedoch eine reduzierte Egg Reappearance Period (ERP), also ein verkürzter Zeitraum bis zum Wiederauftreten von Eiern im Kot beschrieben, was als Hinweis auf eine reduzierte Wirksamkeit betrachtet wird. Es ist daher ratsam, die Wirksamkeit jeder eingesetzten Anthelminthika-Klasse regelmäßig zu überprüfen bzw. zu bestätigen. Unter Praxisbedingungen eignet sich hierzu die einmal jährliche Durchführung eines Eizahlreduktionstests (EZRT).
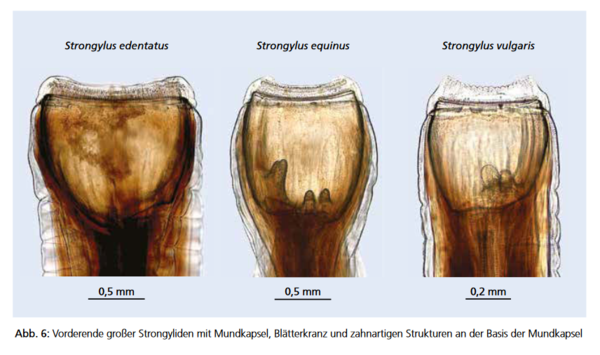
Diese Gruppe im Dickdarm parasitierender Würmer besteht aus wandernden Spezies unterschiedlicher Strongyliden (S. vulgaris, S. edentatus und S. equinus, Abb. 6).
Aus klinischer Sicht handelt es sich gegenwärtig in Deutschland um die wichtigsten Parasiten bei Pferden, wobei S. vulgaris als eine der größten Bedrohungen für die Gesundheit des Pferdes gilt. Bevor sich die Larven im Dickdarm zur vollständigen Reife entwickeln, vollziehen sie eine sehr ausgedehnte, speziesspezifische somatische Wanderung in der kranialen Mesenterialarterie und in naheliegenden Arterien (S. vulgaris, Abb. 7 und Abb. 8), durch die Leber zum subperitonealen Bindegewebe (S. edentatus) sowie zur Leber und in die Pankreas- und Nierenregion (S. equinus). Diese ausgedehnten Larvenwanderungen führen zu langen Präpatenzen von 6–7 Monaten bei S. vulgaris, 9 Monaten bei S. equinus und von 11–12 Monaten bei S. edentatus. Die durch Wanderlarven hervorgerufenen Schäden haben schwerwiegende pathologische Folgen und führen zu klinischen Symptomen, die sich je nach ursächlicher Strongylidenspezies unterscheiden.
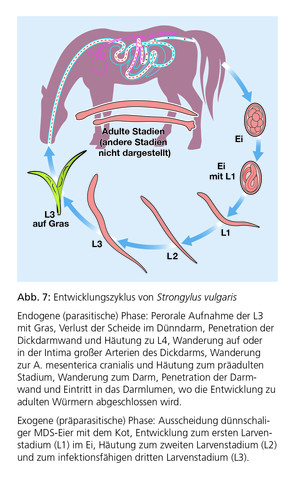
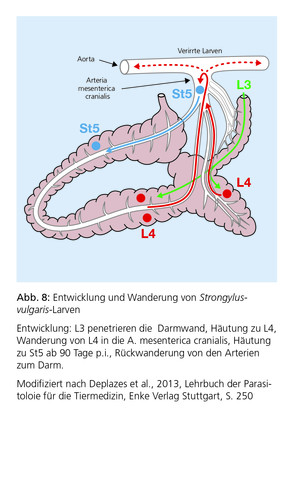
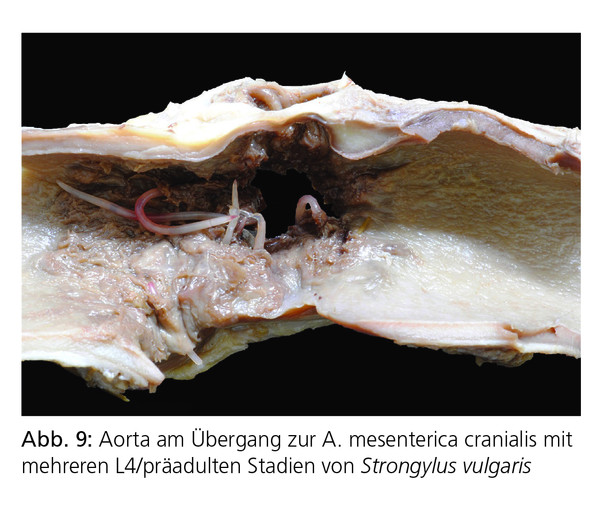
In der Vergangenheit stand vor allem S. vulgaris – der „Pferdekiller“ – im Mittelpunkt des Interesses, insbesondere aufgrund des klinischen Syndroms der thrombotisch-embolischen Kolik, hervorgerufen durch Larven, die zur A. mesenterica cranialis wandern (Abb. 9). Adulte Strongyliden ernähren sich von Schleimhautpfropfen der Darmwand. Die dabei entstehenden Schleimhautschäden führen zu Diarrhoe, Schwäche, Abmagerung und gelegentlich Anämie.
Die wandernden Larven und die von ihnen hervorgerufenen Thrombosen können zu nicht-strangulierenden Darminfarkten führen, die man meist im Dickdarm findet. Abhängig von der Intensität des Befalls können die initialen klinischen Symptome bei nicht-strangulierenden Darminfarkten geringgradig sein und mit häufig rezidivierenden abdominalen Schmerzen (Koliken), Fieber und Peritonitis einhergehen. Wird das infarzierte Darmsegment übersehen und nicht chirurgisch reseziert, kommt es zu Darmnekrosen und Darmrupturen, die schließlich zum Tod des Pferdes führen.
Zu beachten ist, dass gelegentlich sogar Pferde mit hochgradiger intestinaler Nekrose infolge einer Thrombose keinerlei Anzeichen ernsthafter Schmerzen zeigen. Peritonitis ist daher oft das einzige Symptom, das auf die Indikation für eine chirurgische Intervention hindeutet.
Der Nachweis patenter Infektionen mit großen Strongyliden basiert auf der In-vitro-Anzüchtung der dritten Larvenstadien (L3), die dann anhand der Anzahl ihrer Mitteldarmzellen von den L3 anderer Strongyliden unterschieden werden können (siehe auch 8.1. Diagnose von Wurminfektionen).
Traditionell empfohlen werden routinemäßige Entwurmungen in regelmäßigen Abständen bei allen Pferden. Ziel dieser Strategie ist es, den Grad der Weidekontamination zu minimieren und somit die Risiken im Zusammenhang mit Wanderlarven von S. vulgaris zu reduzieren. Dank dieser jahrelangen intensiven metaphylaktischen Behandlungspraxis sind Infektionen mit S. vulgaris heute selten geworden. In jüngster
Vergangenheit wird auch zunehmend ein selektiver Behandlungsansatz empfohlen. Ziel der selektiven Entwurmung ist es, die Entwicklung von AR bei kleinen Strongyliden durch eine Herabsetzung der Behandlungsintensität zu reduzieren. Hierbei bleiben Pferde mit geringen MDS-Eizahlen unbehandelt. Wichtig ist daher eine regelmäßige spezifische Diagnose hinsichtlich möglicherweise im Bestand vorkommender patenter S. vulgaris-Infektionen durch Anzüchtung von L3.
Für die nachhaltige Bekämpfung von Strongylideninfektionen bei Pferden sollten metaphylaktische Entwurmungsprogramme deshalb so konzipiert werden, dass AR verhindert werden (z. B. bei kleinen Strongyliden und Spulwürmern) und gleichzeitig einer Übertragung von großen Strongyliden wie S. vulgaris vorgebeugt wird. Gegenwärtig gibt es keine wissenschaftlichen Berichte über AR bei großen Strongyliden. Eine Behandlung aller Pferde zweimal jährlich mit einem gegen Larven großer Strongyliden (z. B. S. vulgaris) wirksamen Anthelminthikum (z. B. IVM oder MOX) bewirkt eine adäquate Kontrolle dieses Parasiten.
Die Pferde-Spulwurmspezies Parascaris equorum und P. univalens sind morphologisch nicht voneinander zu unterscheiden. Jüngste Untersuchungen zeigen, dass in den meisten, wenn nicht sogar in allen Pferdehaltungen Europas mit Spulwurmbefall, aktuell P. univalens – und nicht etwa P. equorum – die Spezies mit der höchsten Prävalenz ist. Molekulare Tests für eine Speziesdifferenzierung gibt es gegenwärtig nicht. Da beide Arten jedoch eine offenbar sehr ähnliche Pathogenese und Biologie haben, werden sie hier aus Gründen der Vereinfachung einheitlich als Parascaris spp. bezeichnet.
Ein Befall mit Spulwürmern wird überwiegend bei Fohlen und jungen Pferden beobachtet. Jüngste Querschnittsstudien aus Europa zeigen Prävalenzraten von 20 % bis über 80 % bei Fohlen.
Mit einer Länge von bis zu 50 cm im adulten Stadium zählen diese den Dünndarm besiedelnden Würmer zu den größten bekannten Nematodenspezies. Die weiblichen Würmer können täglich Hunderttausende Eier ausscheiden und so in ganz erheblichem Maße zur Kontamination der Umwelt beitragen. Das infektionsfähige Stadium ist die sich im Ei befindende dritte Larve (L3). In dem mit einer dicken Schale ausgestatteten
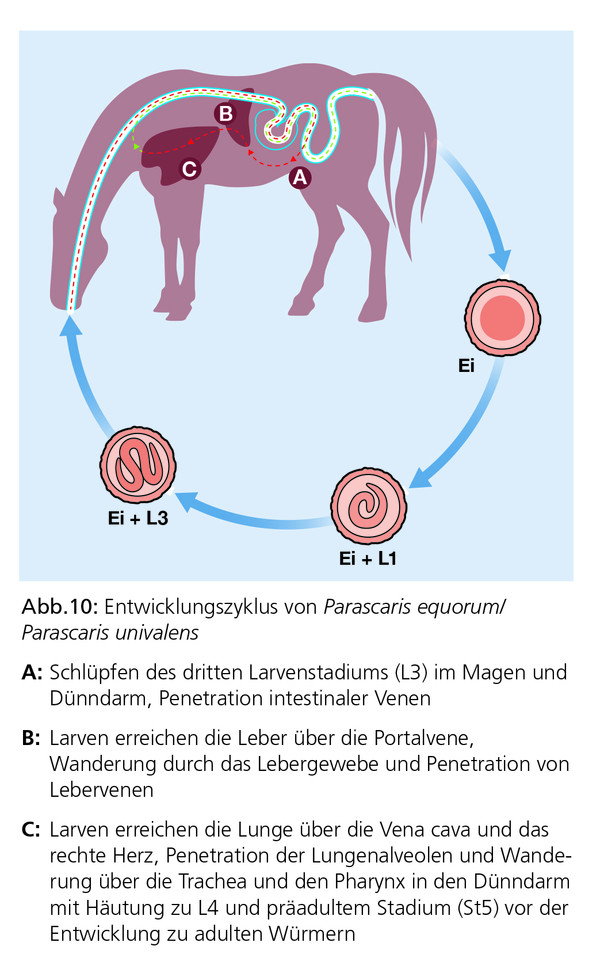
Ei (90–100 μm) ist die L3 in der Außenwelt mehrere Monate, evtl. sogar Jahre überlebensfähig. Dies gilt selbst unter extremen Bedingungen wie lang anhaltende Frostperioden. Einmal kontaminierte Ställe und Weiden bleiben folglich dauerhafte Infektionsquellen. Nach peroraler Aufnahme der Eier werden die Larven im Darm des Pferdes freigesetzt und penetrieren die Dünndarmwand, um anschließend eine somatische Wanderung über den Blutweg in die Leber, das Herz und schließlich in die Lunge anzutreten. In der Lunge gelangen die Larven in die luftführenden Wege, wo sie über das Flimmerepithel der Luftröhre in Richtung Kehlkopf und Rachen transportiert werden und nach dem Abschlucken den Dünndarm des Pferdes etwa drei Wochen nach der Infektion erreichen. Die anschließende Reifung dauert dann mindestens weitere sieben Wochen, bis es zur ersten Ausscheidung von Eiern im Kot kommt (Präpatenzzeit 10–16 Wochen, Abb. 10).
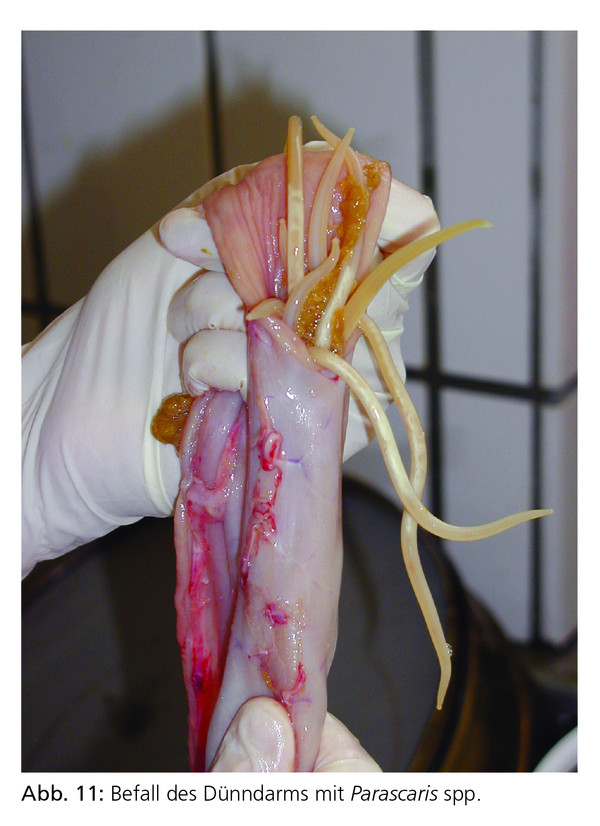
In vielen Fällen werden bei befallenen Pferden keine klinischen Symptome beobachtet. Während der somatischen Wanderung treten gelegentlich klinische Symptome auf, die meist mit pathologischen Veränderungen in der Lunge zusammenhängen. Dagegen scheint die Wanderung durch die Leber keine klinischen Symptome zu verursachen. In der Lunge entstehen hämorrhagische Schleimhautläsionen und hochgradige Infektionen können zu Husten und reduzierter Gewichtszunahme bei jungen Tieren führen. Weitere mögliche Folgen sind sekundäre bakterielle oder virale Infektionen. Während der intestinalen Phase (Abb. 11) zeigen mit Parascaris spp. infizierte Tiere einen reduzierten Appetit und ein raues Fell, es können aber auch intermittierende Koliken und Gewichtsverlust auftreten. Gelegentlich können hochgradige Infektionen zu schweren Koliken, Obstruktion des Dünndarms, Perforationen, Invaginationen und Peritonitis führen. Unter den gegenwärtigen im deutschsprachigen Raum vorherrschenden epidemiologischen Bedingungen ist die Befallsintensität der einzelnen Tiere in fast allen Beständen niedrig. Daher verläuft die überwiegende Mehrzahl aller Fälle bei Fohlen und jungen Pferden subklinisch. Adulte Pferde können gelegentlich Eier ausscheiden und somit als Infektionsquelle für nachfolgende Generationen dienen.
Die Diagnose von Infektionen mit Parascaris spp. basiert auf dem direkten koproskopischen Nachweis der Eier (rund, bräunlich, etwa 100 μm groß, dickschalig) und/oder dem Nachweis präadulter Stadien oder adulter Würmer im Kot. Die koproskopische Analyse stützt sich auf den mikroskopischen Nachweis der Eier mit Hilfe eines qualitativen oder quantitativen Flotationsverfahrens. Wie bei anderen Wirtstieren mit Spulwurmbefall ist es auch bei Pferden nicht möglich, vom Grad der Eiausscheidung im Kot zuverlässig auf die tatsächliche intestinale Wurmbürde zu schließen. Eine positive Kotprobenuntersuchung sollte jedoch immer als Indikation für eine anthelminthische Behandlung gelten. Aufgrund der Umweltkontamination und der langen Überlebenszeiten von Parascaris spp.-Eiern in der Außenwelt ist davon auszugehen, dass Pferde mit negativem Kotbefund, die in derselben Umwelt leben und derselben Altersgruppe angehören, ebenfalls exponiert und wahrscheinlich auch befallen sind. Bei diesen Tieren kann sich die Infektion in der Prä- oder Postpatenz befinden. Im Falle einer positiven Kotprobenuntersuchung bei einem Pferd aus einer Gruppe sollten folglich alle Pferde derselben Altersgruppe entwurmt werden. MLs sind wirksam gegen Larvenstadien in der Lunge und im Darm. Die in der Vergangenheit übliche Empfehlung einer regelmäßigen Entwurmung von Fohlen alle 6–8 Wochen während des ersten Lebensjahres zielte auf eine Prävention der Kontamination der Außenwelt und der nachfolgenden Entwicklung intestinaler Wurmbürden ab. Derartig häufige Entwurmungen gelten jedoch als Hauptursache der Selektion ML-resistenter Parascaris spp.-Populationen und werden daher nicht mehr empfohlen.
Nachhaltige Bekämpfungsstrategien sollten regelmäßige Kotprobenuntersuchungen einschließen (vorzugsweise individueller Proben). Verschiedene Maßnahmen der Stall- und Weidehygiene flankieren die anthelminthische Behandlung, die bei Fohlen im Alter von zwei Monaten eingeleitet und während des ersten Lebensjahres alle drei Monate mit unterschiedlichen Wirkstoffklassen wiederholt werden sollte. Aufgrund der oben erwähnten AR-Situation sollte die Wirksamkeit der eingesetzten Anthelminthikaklassen in jeder Pferdehaltung regelmäßig überprüft werden. Insbesondere gilt dies für die MLs. Diese Überprüfung erfolgt mittels Eizahlreduktionstest (EZRT) oder zumindest über eine Kotprobenuntersuchung auf Wurmeier 14 Tage nach erfolgter Entwurmung. Feldstudien belegen, dass das „Abäppeln“ der Weiden und die chemische oder physikalische Desinfektion von Ställen nachweislich vorteilhafte Effekte haben und zu einer signifikanten Reduzierung der Prävalenz von Parascaris spp. führen. Beim Einsatz von Desinfektionsmitteln ist darauf zu achten, ausschließlich Produkte mit nachgewiesener Wirksamkeit gegen Wurmeier zu wählen (d. h. mit Kresol oder Peressigsäure, siehe auch Kapitel 5). Resistenzen gegen MLs werden bei Parascaris spp. inzwischen weithin beschrieben. Jüngste Berichte aus Nordamerika und Australien weisen zudem darauf hin, dass auch Resistenzen gegen Pyrantel und BZs auf dem Vormarsch sein könnten. In Pferdehaltungen mit bestätigter Resistenz gegenüber MLs können alternativ BZs, Pyrantel oder Piperazincitrat eingesetzt werden. Piperazincitrat muss jedoch in vergleichsweise hoher Dosierung verabreicht werden und die entsprechend großen Applikationsvolumina erfordern oft eine Nasenschlundsonde. Aufgrund des potenziellen Kolikrisikos durch Bildung von Wurmkonvoluten infolge der unmittelbar abtötenden bzw. paralysierenden Wirkung neurotoxischer Anthelminthika, sollten MLs, Pyrantel und Piperazin bei Fohlen mit hochgradigem Befall nicht eingesetzt werden.
Zwei Spezies equiner Bandwürmer sind in Europa von vorrangiger Bedeutung: Anoplocephala perfoliata und A. magna. Die meisten Fälle von Bandwurmbefall bei Pferden werden durch A. perfoliata hervorgerufen. Infektionen mit A. magna werden dagegen nur sehr selten festgestellt. Paranoplocephala mamillana wird ebenfalls gelegentlich in Deutschland nachgewiesen.
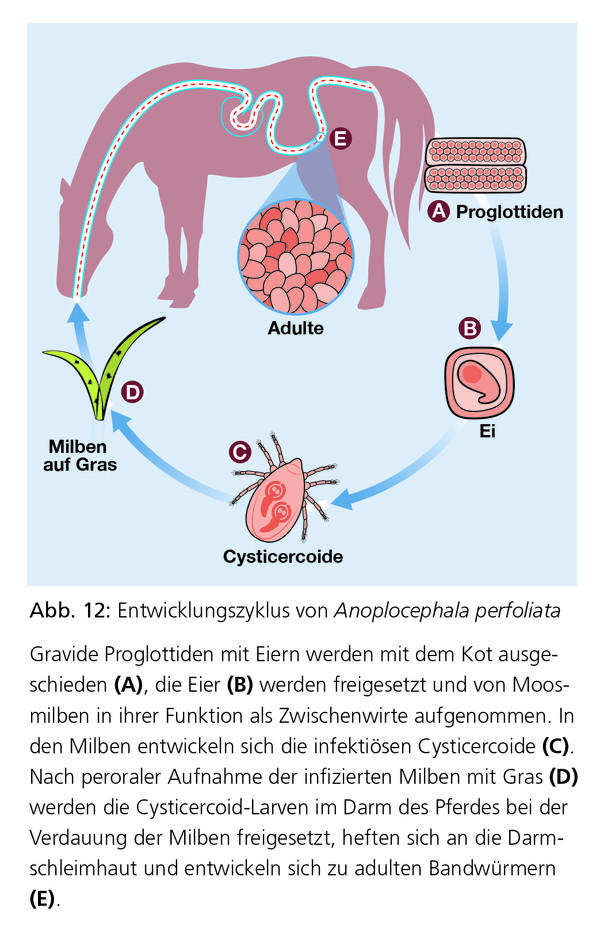
Bandwurmbefall tritt hauptsächlich in der zweiten Hälfte der Weidesaison auf und im Wesentlichen nur auf der Weide nach peroraler Aufnahme infizierter Moosmilben, die den Zwischenwirt für die Bandwürmer darstellen (Abb. 12). Die Präpatenzperiode liegt zwischen 6 Wochen und 4 Monaten. Adulte A. perfoliata (Abb. 13) sind 4–8 cm lang und besiedeln das Zäkum nahe des ileozäkalen Übergangs, während man adulte A. magna (bis zu 80 cm lang) im Dünndarm findet. Hochgradigere Infektionen mit A. perfoliata können mit klinischen Koliksymptomen einhergehen. Ursachen sind Darmirritationen, ileale Wandverdickungen mit Obstruktion sowie Invaginationen und Obstruktionen verschiedener Darmabschnitte, die zu rezidivierenden Schüben spasmodischer Koliken führen können. Das Risiko gastrointestinaler Störungen steigt bei Pferden mit chronischem oder hochgradigem Befall. Die Pathogenität von Anoplocephala magna beschränkt sich auf eine katarrhalische Entzündung und Infektionen verlaufen im Allgemeinen unbemerkt, mit höherer Prävalenz bei jungen Pferden unter zwei Jahren.

Die koproskopische Diagnose des Bandwurmbefalls bei Pferden weist nur eine begrenzte Sensitivität auf, da die Eier A. perfoliata (65–80 μm, mit Onkosphäre und birnenförmigen Apparat) intermittierend ausgeschieden werden, und dies ohne Korrelation mit der tatsächlich vorhandenen Anzahl von Bandwürmern im Darm. Zur Verbesserung des Nachweises von Anoplocephala-Eiern im Kot von Pferden wurden kombinierte Sedimentations-Flotations-Techniken mit Zentrifugation entwickelt. Dabei werden vergleichsweise große Kotprobenmengen (15–50 g) verarbeitet und untersucht. Um die begrenzte Sensitivität der koproskopischen Diagnose zu kompensieren, wird darüber hinaus empfohlen, eine Herden-/Bestandsdiagnose durchzuführen und alle Pferde des Bestandes zu entwurmen, wenn Bandwurmeier in einer der untersuchten Proben nachgewiesen wurden.
Zudem sind diagnostische Tests erhältlich, die A. perfoliata-Antikörper mittels Serum-ELISA (Diagnosteq, Universität Liverpool, UK) oder Speichel-ELISA (EquiSal, Austin Davis Biologics, Great Addington, UK) nachweisen. Beide Tests können möglicherweise bei einigen Pferden (z. B. bei zuvor infizierten und anthelminthisch behandelten Tieren) aufgrund der Persistenz von Antikörpern für bis zu vier Monaten zu falschpositiven Ergebnissen führen. Wenn dies berücksichtigt wird, können sich diese Tests jedoch als sehr nützlich erweisen. Dies gilt insbesondere für die Diagnose auf Gruppen- bzw. Betriebsebene mit dem Serumtest oder die gezielte Behandlung von Patienten aufgrund der Untersuchung mittels des Speicheltestes.
Die Entwurmung von Pferden mit Bandwürmern stützt sich auf die Anwendung zestozider Anthelminthika. Der Wirkstoff der Wahl ist Praziquantel. Praziquantel ist in Deutschland sowohl in Mono- als auch in Kombinationspräparaten zusammen mit MLs (z. B. Ivermectin oder Moxidectin) erhältlich. Werden zur Entwurmung ausschließlich Anthelminthika eingesetzt, die nur gegen Nematoden wirksam sind, kann ein nicht diagnostizierter Bandwurmbefall in Pferdegruppen über mehrere Jahre persistieren. Aktuell scheinen zestozide Anthelminthika nach wie vor vollständig wirksam zu sein. Eine zuverlässige Evaluierung der Wirksamkeit von Anthelminthika gegen Bandwürmer ist mit Hilfe der gegenwärtig eingesetzten diagnostischen Methoden jedoch schwierig, da diese Verfahren eine geringe Sensitivität aufweisen bzw. bei auf Antikörper-Nachweis beruhenden Verfahren eine Antikörper-Persistenz nach Behandlung zu berücksichtigen ist.
Nachhaltige Strategien zur Bekämpfung von Bandwürmern sollten stets auch die spezifischen regionalen klimatischen Bedingungen berücksichtigen. Zudem sollten Monitoringsysteme eingerichtet werden, mit deren Hilfe die Relevanz von Bandwurmbefall auf der Ebene des einzelnen Betriebes festgestellt werden kann. Routinemäßige Mehrfachentwurmungen über das gesamte Jahr hinweg, wie sie zur Bekämpfung von kleinen Strongyliden gerechtfertigt sind, werden für die Bandwurmbekämpfung nicht empfohlen, da Bandwürmer einen anderen Entwicklungszyklus mit einem Zwischenwirt haben. Zudem ist die Übertragung von Bandwürmern von einer stark ausgeprägten Saisonalität gekennzeichnet. Im Allgemeinen reicht eine einzige jährliche Bandwurmbehandlung im Spätherbst oder Winter aus, um einen signifikanten Befall zu verhindern. In Situationen mit hohem Infektionsdruck kann jedoch eine zusätzliche frühere Behandlung während des Sommers angezeigt sein. Regelmäßiges Entfernen von Kot auf der Weide (mindestens einmal wöchentlich) kann langfristig ebenfalls zu einer Senkung des Infektionsdrucks beitragen.
Dasselfliegen sind Arthropoden der Gattung Gasterophilus (Diptera: Oestridae). Die höchste Prävalenz in Europa haben Gasterophilus intestinalis, G. haemorrhoidalis, G. nasalis, G. inermis und G. pecorum. Gasterophilus intestinalis, G. haemorrhoidalis und G. nasalis treten häufig bei grasenden Pferden auf. G. inermis und G. pecorum werden dagegen seltener nachgewiesen. Ihre Larven verursachen hauptsächlich eine gastrointestinale Myiasis.
Adulte Fliegen haben ein hummelartiges Aussehen und die weiblichen Fliegen spielen die Hauptrolle bei der Infektion von Pferden. In Südeuropa können sie bereits im Frühjahr/Frühsommer aktiv sein, während die Eiablage in den gemäßigten Regionen eher im Spätsommer stattfindet. Weibliche Fliegen der meisten Gasterophilus-Arten haben einen kleinen Aktionsradius und halten sich meist sehr nahe an Pferden auf. Sie fliegen die Haut der Pferde sehr schnell an, um ein Ei an einem Haar zu befestigen. Diese Flugaktivitäten verursachen ein spezielles summendes Geräusch, das viele Pferde als sehr störend empfinden. Nach Ablage der kleinen (1–2 mm), meist gedeckelten, gelblichen Eier sterben die Weibchen. Die an den Haaren haftenden Eier sind relativ gut mit bloßem Auge zu erkennen, insbesondere bei Pferden mit dunklem Fell. Gasterophilus intestinalis legen ihre Eier an Haare der Vorderextremitäten, des Schulterblatts und der Flanken, während die Eiablage der meisten anderen Dasselfliegenarten vorwiegend im Kopfbereich des Pferdes stattfindet. Eine Ausnahme bildet G. pecorum, deren weibliche Fliegen ihre Eier in der Umgebung an Weidepflanzen ablegen. Menschen werden gelegentlich befallen und zeigen hinweisgebende Bohrgänge in der Haut der Wangen und sogar Infektionen des Verdauungstraktes.
Das Schlüpfen der ersten Larvenstadien (L1) findet nach einem mechanischen Stimulus (G. intestinalis und G. pecorum) oder spontan (G. nasalis) statt. Die L1 erreichen die Maulhöhle durch perorale Aufnahme (Lecken bei G. intestinalis bzw. Grasen bei G. pecorum) oder durch Larvenwanderung. Die zweiten Larvenstadien (L2) findet man im Magen und im Duodenum des Pferdes, wo sie sich zum dritten Larvenstadium (L3) häuten. Die L3 sind 16–20 mm lang, haben eine spindelähnliche Form und besitzen zwei große Mundhaken. Die einzelnen Segmente weisen eine oder zwei Reihen von Dornenkränzen auf.
Nach mehreren Monaten verlassen die L3 schließlich den Wirt mit den Fäzes und verpuppen sich im Erdboden, bis die adulten Fliegen schlüpfen und in die Umwelt gelangen. Die parasitäre Phase dauert 8–10 Monate, die Puppenphase 3–8 Wochen. Die adulten Fliegen treten meistens in den Monaten Juni und Juli auf und sind in der Regel bis Oktober oder November aktiv.
Die L2/L3 verschiedener Gasterophilus spp. heften sich speziesspezifisch an die Schleimhaut des Magens (G. intestinalis), des Duodenums (G. nasalis, G. haemorrhoidalis) oder des Rektums (G. haemorrhoidalis, G. inermis), wo sie fokale oberflächliche Schleimhautulzera und Gewebeverletzungen hervorrufen, um ihre Nahrungsaufnahme zu erleichtern. Die L1 wandern in der Maulhöhle durch die Schleimhaut der Zunge, des Zahnfleisches und des Gaumens und verursachen Zahnfleischentzündungen und damit Schmerzen, die zu einer Beeinträchtigung der Futteraufnahme führen können. Erste klinische Symptome einer Gasterophilose sind meist Schluckbeschwerden, bedingt durch die Lokalisation der Larvenstadien im Rachenbereich. Da jedoch selbst ein massiver Befall nicht immer mit klinischen Symptomen einhergeht, gelten Gasterophilus spp. im Allgemeinen als sehr viel weniger pathogen als parasitäre Nematoden. Allerdings wird Gasterophilus-Befall auch mit Magen- und Darmgeschwüren in Verbindung gebracht, ebenso wie mit chronischen Gastritiden, Darmobstruktionen, Volvulus, Rektalprolaps, Ruptur der Gastrointestinalwand, Peritonitis, Anämie und Diarrhoe.
Der Nachweis von Gasterophilus spp. erfolgt im Sommer/Herbst durch Adspektion des Fells der Pferde und den optischen Nachweis der an den Haaren klebenden gelblichen Eier. Mittels gastrointestinaler Endoskopie können zudem die an der Wand von Magen und Duodenum verankerten Gasterophilus-Larven nachgewiesen werden. In Europa gibt es neben PCR-Techniken auch einen ELISA für den Antikörpernachweis auf Basis exkretorischer/sekretorischer Antigene von G. intestinalis-L2. In der Praxis sind diese Verfahren bislang aber noch nicht routinemäßig einsetzbar.
Die Larvenstadien von Gasterophilus spp. sind hoch empfindlich gegenüber MLs (insbesondere Ivermectin) und werden im Rahmen einer routinemäßigen Entwurmung mit diesen Wirkstoffen zuverlässig eliminiert. Da die Aktivität der Fliegen mit dem Einsetzen der ersten Frosttemperaturen sistiert, sollte eine geeignete Behandlung des Pferdes im Spätherbst (z. B. im frühen November) sämtliche vorhandenen Larven entfernen. Zusätzlich empfohlen wird das mechanische Entfernen der im Fell klebenden Eier mit einem speziellen Dasselmesser oder durch gründliches Waschen der Haare mit warmem insektizidhaltigen Wasser. Allein sind diese flankierenden Maßnahmen in der Regel aber nicht ausreichend, um eine gastrointestinale Infektion zu verhindern.
Der Nematode Strongyloides westeri besiedelt den Dünndarm und hier hauptsächlich das Duodenum. Patente Infektionen werden überwiegend bei jungen Pferden nachgewiesen, d. h. bei Fohlen bis zu sechs Monaten. Gelegentlich können auch ältere Pferde befallen sein und Stuten sind eine wichtige Infektionsquelle für ihre Fohlen. Es handelt sich um außergewöhnliche Parasiten, da sich nur weibliche parasitische Stadien entwickeln. Diese sehr schlanken, kleinen (maximal 10 mm lang) parasitischen Weibchen pflanzen sich parthenogenetisch (d. h. durch Jungfernzeugung) fort und scheiden kleine, dünnschalige, embryonierte Eier (40–50 x 30–40 μm) aus, die bereits das erste Larvenstadium (L1) enthalten. Die L1 schlüpfen in der Außenwelt und können sich zu infektionsfähigen dritten Larvenstadien (L3) entwickeln, die einen Wirt infizieren oder freilebende männliche und weibliche Stadien hervorbringen, die sich fortpflanzen und Eier in der Umwelt legen, aus denen wiederum infektionsfähige L3 entstehen.
Die Infektion der Fohlen erfolgt galaktogen durch perorale Aufnahme der L3 mit der Milch der Stute. Die galaktogene Infektion ist der primäre Übertragungsweg von S. westeri auf Fohlen. Später kann eine Übertragung auch durch perorale Aufnahme der infektionsfähigen L3 aus der Umwelt, vorrangig auf der Weide, erfolgen oder auf dem Weg der perkutanen Infektion. Bei immunen adulten Pferden kommt es nach perkutaner Infektion nur sehr selten zu einer Etablierung von S. westeri-Larven im Verdauungstrakt und somit kaum zu patenten Infektionen. Stattdessen verteilen sich die Larven in verschiedenen somatischen Geweben, wo sie über längere Perioden, möglicherweise über mehrere Jahre, lebensfähig bleiben. Bei befallenen Stuten führen hormonelle Veränderungen im Zusammenhang mit der Gravidität und der Laktation zu einer Reaktivierung dieser Larven, die dann eine Wanderung in Richtung Euter aufnehmen und schließlich über die Milch auf das Fohlen übertragen werden. Nach peroraler Aufnahme mit der Muttermilch vollziehen die Larven im Fohlen keine somatische Wanderung, sondern siedeln sich unmittelbar im Dünndarm an. Dort entwickeln sie sich zu parthenogenetischen Weibchen, wodurch sich eine auf 5–8 Tage verkürzte Präpatenz erklärt. Nach Aufnahme freilebender L3 durchlaufen diese eine somatische Wanderung, die mit der Penetration der Dünndarmwand beginnt. Anschließend wandern die Larven durch die Lunge und gelangen über die Trachea zum Pharynx, wo sie abgeschluckt werden und schließlich den Dünndarm erreichen. Dort reifen sie zu adulten weiblichen Würmern heran. Die Präpatenz kann sich über einige Wochen erstrecken, aber auch nur 10 Tage dauern.
Bei Pferden mit massiver perkutaner Infektion kann eine lokale Dermatitis entstehen. Das Fell kann stumpf sein und durch lokale Hautreizungen und Juckreiz können betroffene Tiere gestresst werden. Oft handelt es sich dabei um die Folgen einer allergischen Reaktion auf Reinfektionen. Der pathogene Haupteffekt der Infektion tritt jedoch im Darm auf, wo sich adulte weibliche Würmer in die Dünndarmschleimhaut einbetten und eine lokale Enteritis verursachen, die zu Diarrhoe führen kann. Unklar ist jedoch, welche Rolle S. westeri tatsächlich als Ursache von Diarrhoe bei jungen Fohlen spielt, da es zum einen Berichte über hohe fäkale Eizahlen in Kombination mit hochgradiger Diarrhoe gibt, während man aber auch hohe Ausscheidungen von Strongyloides-Eiern bei Fohlen ohne jegliche klinische Symptome findet. Klinisch erkrankte Fohlen können anorektisch und lethargisch werden. Wo regelmäßig entwurmt wird, scheinen die meisten Infektionen mit S. westeri asymptomatisch zu verlaufen. Zu berücksichtigen ist, dass viele Fälle von Fohlendurchfall in den ersten 1–2 Lebenswochen keinen Zusammenhang mit S. westeri-Infektionen haben.
Die Diagnose einer Infektion mit S. westeri erfolgt über den koproskopischen Nachweis der typischen Eier im Kot.
Für eine wirksame Bekämpfung von S. westeri-Infektionen sollten Anthelminthikagaben mit grundlegenden Hygienemaßnahmen kombiniert werden. In Anbetracht der aktuellen epidemiologischen Situation scheint die früher häufig propagierte Strategie der routinemäßigen Entwurmung von Fohlen während der ersten Lebenswochen heute nicht mehr gerechtfertigt. Dies liegt zum einen an der niedrigen Prävalenz und zum anderen an der fehlenden Evidenz für S. westeri-assoziierte Erkrankungen bei Fohlen. In Pferdehaltungen, in denen S. westeri zuvor bereits nachgewiesen worden ist, kann eine Entwurmung von Stuten vor oder kurz nach der Geburt (1–2 Tage post partum) erwogen werden. Diese hat das Ziel, die Anzahl der Larven in der Milch zu reduzieren, um gegebenenfalls die Inzidenz von Fohlendurchfall zu senken. Für die Behandlung klinischer Fälle stehen einige wirksame Anthelminthika zur Verfügung, einschließlich Ivermectin und Fenbendazol, wobei Letzteres in einer Dosierung von 50 mg/kg Körpergewicht verabreicht werden muss (signifikant höher als die Standarddosierung von 7,5 mg/kg Körpergewicht). Adäquate Weide- und Stallhygiene, kombiniert mit einer regelmäßigen Reinigung der Euter von Stuten, sollte die Risiken einer Umweltkontamination und einer Infektion von Fohlen zusätzlich reduzieren.
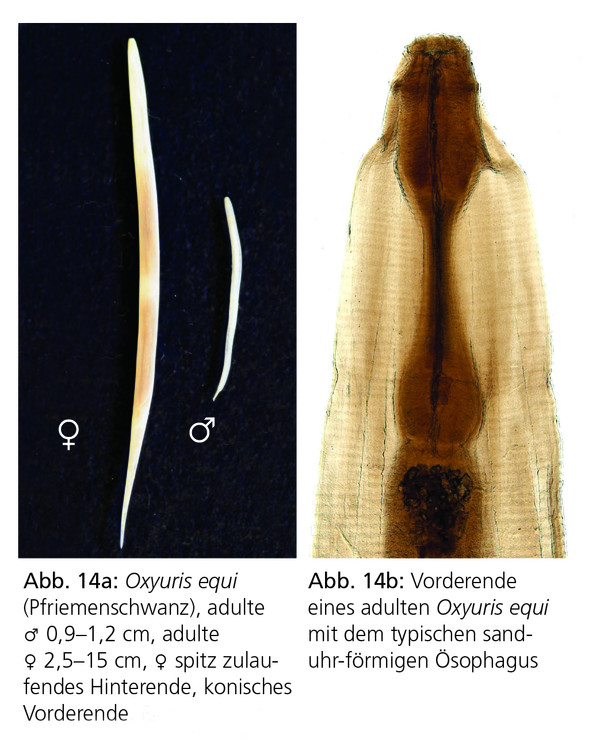
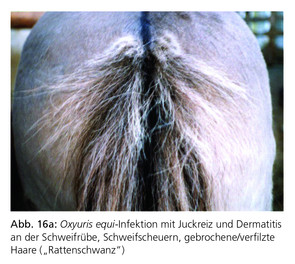
Der equine Pfriemenschwanz Oxyuris equi (Abb. 14a, 14b und 15) wird als ein in Europa häufig auftretender Pferdeparasit beschrieben. Infektionen entstehen häufig im Stall, können aber auch auf der Weide auftreten. In der Regel scheinen aber nur einige wenige Pferde klinisch zu erkranken. Oxyuris equi wird demzufolge nur selten als eine relevante Bedrohung der Gesundheit von Pferden betrachtet. Ein hochgradiger Befall kann jedoch zu Müdigkeit, Leistungsminderung und Konditionsverlust führen. In der Regel führt aber selbst massiver Befall mit dem vierten Larvenstadium nicht zu klinischen Symptomen. In Einzelfällen können die Larven jedoch zu hochgradigen Entzündungen der Dickdarmschleimhaut mit unspezifischen intestinalen Symptomen führen.
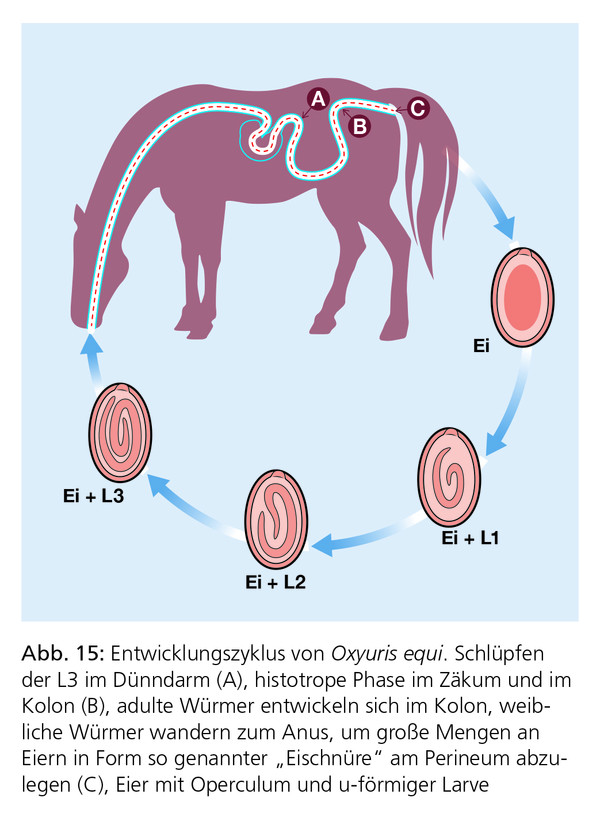
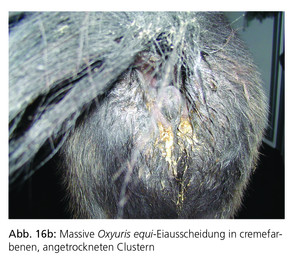
Die weiblichen Würmer legen eine beträchtliche Anzahl von Eiern (Zehn- bis Hunderttausende) auf der Haut im Perianalbereich des Pferdes ab. Die Eier sind von einer klebrigen Flüssigkeit umgeben, die beim Eintrocknen intensiven Juckreiz verursacht. Hinweise auf eine Infektion sind deshalb ein persistierender analer Juckreiz und häufiges Scheuern der Schweifrübe, das zu Exkoriationen und haarlosen Stellen am Schweif führt (Abb. 16a und Abb. 16b).
Die Diagnose eines Befalls mit Pfriemenschwänzen erfolgt durch Pressen eines transparenten Klebestreifens auf die Haut im Perianalbereich und den anschließenden mikroskopischen Nachweis der charakteristischen ovalen Oxyureneier (85–95 x 40–45 μm). Diese enthalten eine embryonierte, U-förmige Larve, sind an einer Seite abgeflacht und weisen an einem Ende einen Deckel auf.
Um den Juckreiz zu lindern und eine Ausbreitung der Eier in der Umgebung des Pferdes zu verhindern, sollte die Perianalregion befallener Pferde täglich mit warmem Wasser, das ein mildes Desinfektionsmittel enthält, abgewaschen werden. MLs und BZs sind wirksam gegen Pfriemenschwänze und ihre Larvenstadien. Pyrantel zeigt eine variable Wirksamkeit gegen Pfriemenschwänze. Jüngste anekdotische Berichte über eine reduzierte Wirksamkeit von MLs (Ivermectin und Moxidectin) gegen O. equi müssen als Hinweise auf eine potenziell bestehende Anthelminthika-Resistenz betrachtet werden.
Die Bekämpfung von Parasitenbefall bei Pferden basiert gegenwärtig hauptsächlich auf der Anwendung von Anthelminthika mit dem Ziel der Elimination intestinaler Wurmbürden und damit einer Reduktion der Kontamination der Umwelt mit Eiern und/oder infektiösen Stadien. Diese medikamentöse Strategie ist jedoch allein ohne weitere Maßnahmen zur Prävention oder Minimierung der Befallsintensität nicht ausreichend nachhaltig. Unter anderem liegt dies an der Entwicklung von AR bei einigen Parasitenspezies. Flankierende Maßnahmen der Stall- und Weidehygiene sind folglich wichtige Bestandteile einer integrierten Strategie zur Wurmbekämpfung und sollten in jeder Pferdehaltung systematisch geplant und umgesetzt werden. Die infektionsfähigen Stadien einiger Pferdeparasiten haben das Potenzial, über mehrere Monate oder sogar Jahre in der Außenwelt zu überleben. Folgende Faktoren müssen dabei berücksichtigt werden:
Entwurmungsassoziierte Faktoren wie eine Unterdosierung oder eine hohe Frequenz anthelminthischer Behandlungen sind wahrscheinlich die wichtigsten Ursachen für das Aufkommen anthelminthischer Resistenzen (AR). Um eine Selektion auf AR zu reduzieren, sollten Entwurmungen generell so selten wie möglich erfolgen, ohne dabei jedoch das Risiko der Entstehung von Erkrankungen zu erhöhen. Entscheidend sind deshalb regelmäßige Kotprobenuntersuchungen mit Differenzierung zwischen kleinen und großen Strongyliden, um den Infektionsstatus des Einzeltieres oder der jeweiligen Altersgruppe ganzjährig zu überwachen. Wichtig sind darüber hinaus sorgfältige Hygiene- und Quarantänemaßnahmen in Ställen und auf Weiden, um den Infektionsdruck insgesamt zu senken und damit auch die Notwendigkeit häufiger anthelminthischer Behandlungen zu reduzieren.
Experten für Wurmbekämpfung bei Pferden empfehlen heute zwei alternative Ansätze für die Bekämpfung kleiner Strongyliden: Die „selektive Entwurmung“ und die „strategische Entwurmung“.
Im folgenden Abschnitt werden beide Ansätze kurz beschrieben und diskutiert. Beide Strategien gelten als wirksam für die Prävention klinischer Erkrankungen bei adulten Pferden, wenn sie gemäß dieser Empfehlungen umgesetzt werden. Das spezifische Potenzial beider Strategien hinsichtlich einer Abschwächung der Entwicklung von AR ist weitgehend von der jeweils tatsächlich zustande kommenden Entwurmungshäufigkeit pro Pferd und Jahr abhängig. Vergleichbare Daten liegen bislang nicht vor, sollten für zukünftige Analysen dieser beiden Strategien aber erhoben werden. Ungeachtet dessen ist entscheidend, dass Tierärzte und andere für die Gesundheit von Pferden verantwortliche Personen den tatsächlichen
AR-Status der in den jeweiligen Pferdehaltungen vorkommenden Parasiten kennen. In Betrieben, in denen die Resistenz einer spezifischen Wurmspezies gegenüber einer bestimmten Anthelminthikaklasse nachgewiesen ist (mittels Eizahlreduktionstest oder wenigstens durch Kotprobenuntersuchung nach Behandlung), müssen strategische Überlegungen hinsichtlich der zukünftigen Anwendung dieser Anthelminthikaklasse angestellt werden. Generell gilt aber, dass die jeweilige Anthelminthikaklasse gegen die resistente Wurmspezies nicht mehr eingesetzt werden sollte.
Wiederholte Infektionen mit kleinen Strongyliden treten bei Weidepferden aller Altersgruppen auf. Bei der Mehrzahl der adulten Pferde führt eine entsprechende Immunantwort jedoch zu einer Suppression der Eiproduktion kleiner Strongyliden.
Mehrere Studien lieferten Belege für eine konsistente Ausscheidungsintensität von Strongylideneiern nach Entwicklung einer entsprechenden Immunität bei individuellen Pferden.
Dieses Phänomen bildet die Grundlage für das Konzept der selektiven Entwurmung, bei der nur Pferde eine anthelminthische Behandlung erhalten, die eine konsistent hohe Ausscheidung von Strongylideneiern oberhalb eines bestimmten Schwellenwertes, z. B. 200 MDS-Eier pro Gramm (EPG) Kot, aufweisen. Praktisch bedeutet dies, dass im ersten Jahr der Umsetzung dieses Konzeptes Kotproben von jedem einzelnen
Pferd mindestens viermal jährlich untersucht werden. Alle Pferde mit MDS-EPGs über dem definierten Schwellenwert werden entwurmt. Wenn der verantwortliche Tierarzt die epidemiologische Situation als stabil einschätzt, kann die Häufigkeit der Kotdiagnostik in den darauffolgenden Jahren auf drei jährliche Untersuchungen reduziert werden (Beginn, Mitte und Ende der Saison, siehe Tabelle 2).
Die selektive Entwurmung wird nur für adulte Pferde empfohlen und ist ausschließlich für die Bekämpfung kleiner Strongyliden konzipiert.
Das Ziel ist eine Erhöhung des Anteils von Eiern bzw. Larven kleiner Strongyliden auf der Weide, die von adulten Würmern produziert wurden, die keiner anthelminthischen Behandlung ausgesetzt waren. Diese werden als Refugium empfindlicher Parasiten bezeichnet. Einer Hypothese zufolge verhindert oder verzögert ein großes Refugium in der Außenwelt lebender Parasitenstadien die Entwicklung der AR. In verschiedenen Studien, einschließlich einiger Untersuchungen aus Europa, hat die Anwendung des Prinzips der selektiven Entwurmung nachweislich zu einer signifikanten Reduktion der Anzahl anthelminthischer Behandlungen bei Pferden geführt. In diesen Studien entwickelten die Pferde keine auf Parasiteninfektionen zurückzuführenden klinischen Symptome.
Ob die intestinale Wurmbürde von Pferden, die nur geringe Mengen von MDS-Eiern ausscheiden, tatsächlich vernachlässigt werden kann, ist nicht vollständig gesichert. Wie oben erwähnt gilt eine hohe Entwurmungsfrequenz als eine der wichtigsten Ursachen für das Aufkommen von AR. Hohe Entwurmungsfrequenzen sind allerdings besonders bei Fohlen und Jährlingen ein Thema, bei denen die früher üblichen Empfehlungen für Entwurmungen alle 4–8 Wochen heute nicht mehr gegeben werden sollten. Nicht erwiesen ist bis heute jedoch, ob die selektive Entwurmung bei adulten Pferden tatsächlich einen signifikanten Einfluss auf die angestrebte verminderte Entwicklung von AR hat oder ob die Reduzierung der Entwurmungshäufigkeit bei Fohlen und jungen Pferden diesbezüglich eine höhere Relevanz besitzt.

Grundsätzlich sind in diesem Zusammenhang ebenfalls die Ergebnisse einer dänischen Studie erwähnenswert, denen zufolge die hoch pathogene große Strongylidenspezies Strongylus vulgaris eine höhere Prävalenz in Betrieben aufwies, die ihre Pferde in den vorangegangenen Jahren selektiv
entwurmt hatten, als in den Betrieben, die in diesem Zeitraum strategische Entwurmungen der gesamten Herde durchgeführt hatten. Hier ist jedoch anzumerken, dass sich die in diesen Betrieben angewendete Vorgehensweise der selektiven Entwurmung von dem hier beschriebenen Behandlungsansatz unterscheidet. Dies gilt insbesondere, was das Monitoring von S. vulgaris und die sich daraus ableitenden Behandlungsentscheidungen betrifft.
In jüngsten europäischen Studien wurden Strongylus vulgaris oder andere große Strongylidenspezies bei Pferden mit Hilfe von Larvenkulturen und dem mikroskopischen Nachweis von L3 nicht oder nur noch sehr selten gefunden. In mehreren Einzelfällen und in einzelnen Studien wurde S. vulgaris-Befall und zwar oft einhergehend mit hochgradigen klinischen Konsequenzen festgestellt. Diese Ergebnisse weisen darauf hin, dass große Strongyliden nach wie vor präsent sind, wenn auch mit niedriger Prävalenz. Das routinemäßige Monitoring großer Strongyliden mit Hilfe von Larvenkulturen muss folglich ein integraler Bestandteil eines jeden selektiven Entwurmungsprogramms sein. In Pferdehaltungen, in denen große Strongyliden nachgewiesen wurden, ist der selektive Behandlungsansatz zunächst nicht zu empfehlen. Bevor Pferdehaltungen mit nachgewiesenen großen Strongyliden in ein selektives Entwurmungsprogramm aufgenommen bzw. erneut aufgenommen werden, sollten alle Pferde mit Weidezugang über mindestens zwei Jahre zweimal jährlich (im späten Frühjahr und im Herbst/Winter) mit Anthelminthika, die nachweislich gegen adulte Stadien UND gegen Larvenstadien großer Strongyliden wirksam sind (MLs und FBZ), entwurmt werden. Der Befallsstatus mit großen Strongyliden sollte mindestens einmal jährlich durch eine Untersuchung gepoolter Larvenkulturen dokumentiert werden. Alle weiteren Entwurmungsentscheidungen liegen in der Verantwortlichkeit des behandelnden Tierarztes in Abstimmung mit den Pferdebesitzern.
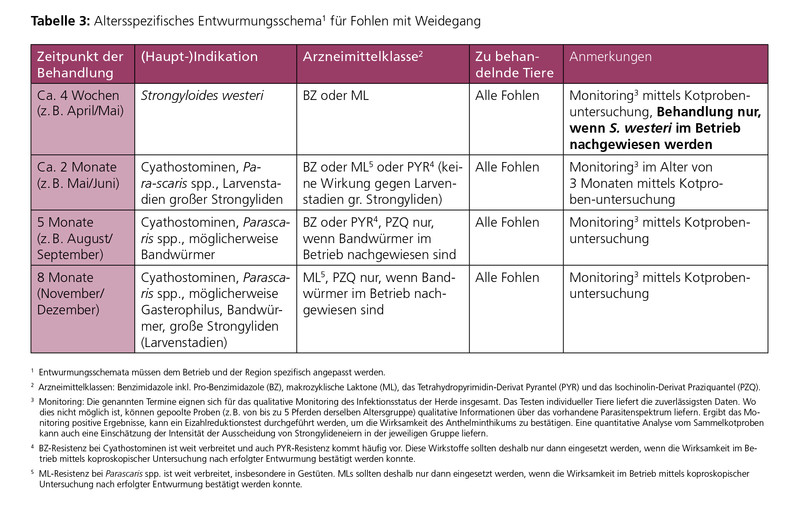
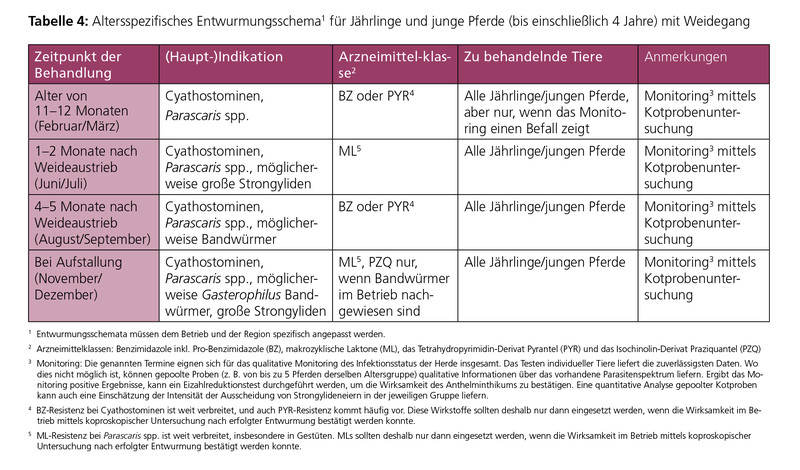
Das Alter eines Pferdes und seine Nutzungsart können einen wichtigen Einfluss auf die geeignete Entwurmungsstrategie haben. Insbesondere Fohlen aber auch junge Pferde benötigen einen umfassenden Schutz durch regelmäßige anthelminthische Behandlungen, selbst in gut geführten Pferdehaltungen mit optimaler Stall- und Weidehygiene. Die in der Vergangenheit oft gegebene Empfehlung, Fohlen häufig zu entwurmen (etwa alle 4–8 Wochen während des ersten Lebensjahres) gilt heute aufgrund des AR-Aufkommens, z. B. bei Spulwürmern und kleinen Strongyliden, als obsolet. Die erste Entwurmung während der Weidesaison findet im Allgemeinen entweder mit dem Weideaustrieb oder ein bis zwei Monate später statt. Der spätere Termin gilt als strategisch sinnvoller, um einen stärkeren epidemiologischen Effekt auf die Produktion von Strongylidenlarven und somit auf die Weidekontamination zu erreichen.
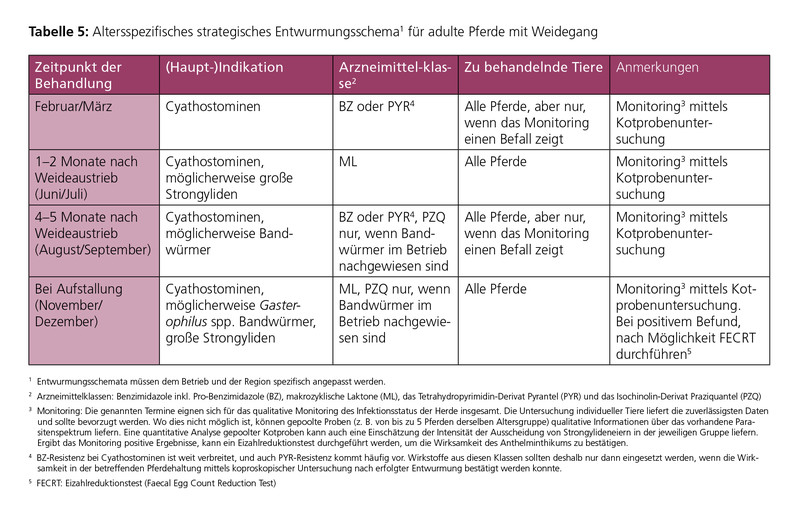
Die altersgruppenspezifischen Entwurmungsschemata in den Tabellen 3–5 geben konkrete Empfehlungen für Bekämpfungsmaßnahmen (einschließlich Monitoring von Infektionen) und deren Zeitpunkte im Verlauf eines Jahres. Nach dieser Strategie werden im Allgemeinen alle Tiere derselben Altersgruppe behandelt.
Ein Nachteil der strategischen Entwurmung ist, dass zum Teil auch Pferde anthelminthisch behandelt werden, deren Darm keine oder nur sehr wenige Würmer beherbergt. Wie oben erwähnt, handelt es sich dabei leider nicht notwendigerweise um Pferde, die keine Wurmeier im Kot aufweisen, da auch Pferde ohne aktuelle Wurmeiausscheidung hohe Wurmzahlen in sich tragen können. Man geht davon aus, dass eine Reduktion der Anwendung von Antiparasitika aus derselben Wirkstoffklasse auf maximal zweimal pro Jahr zu einer Abnahme der Selektion auf anthelminthische Resistenzen führt. Da gegenwärtig wissenschaftlich nicht belegt ist, ob zwei jährliche Entwurmungen bei equinen Helminthen nicht doch zu einer AR-Selektion führen, empfehlen einige Experten diese Vorgehensweise nicht.
Entwurmungsschemata und Empfehlungen für die Bekämpfung parasitärer Infektionen sollten gegenüber den Mitarbeitern der tierärztlichen Praxis klar kommuniziert werden, um eine konsistente Umsetzung sicherzustellen. Die Aufgabe von TierärztInnen, Tierärztlichen Fachangestellten und anderen im Bereich Tiergesundheit tätigen Personen ist es, den PferdebesitzerInnen präventive Maßnahmen, das routinemäßige Monitoring und die Praxis des regelmäßigen Entwurmens verständlich zu erläutern.
Das Ziel eines jeden Programms zur Parasitenbekämpfung bei Pferden ist die Minimierung des Risikos der Entstehung parasitärer Erkrankungen. Dazu gehören strategische Entwurmungen oder, bei adulten Pferden, selektive Entwurmungen. Beide Entwurmungsstrategien müssen jedoch von wirksamen Maßnahmen der Stall- und Weidehygiene begleitet werden. In regelmäßigen Abständen sollten Wurm-Eizahlbestimmungen durchgeführt werden, um die Wirksamkeit der eingesetzten Anthelminthika zu überwachen und somit jegliche Anzeichen der Entwicklung von AR frühzeitig zu erkennen, insbesondere bei kleinen Strongyliden und Spulwürmern.
Parasitenbekämpfungsprogramme müssen den spezifischen Bedingungen jeder einzelnen Pferdehaltung individuell angepasst werden und sollten nach Möglichkeit immer unter tierärztlicher Leitung abgestimmt und entwickelt werden.
Wie bei den meisten Wirtstieren ist die Kotprobenuntersuchung auch bei Pferden nach wie vor die Methode der Wahl, um Tiere mit Wurmbefall zu erkennen.
Der Nachweis von Eiern und/oder Larven von Nematoden bzw. Trematoden und Zestoden erfolgt mit Hilfe der grundlegenden Techniken der Flotation und der Sedimentation sowie der Kombination beider Verfahren, gefolgt von einer mikroskopischen Untersuchung. Jüngste Forschungsarbeiten führten zu Entwicklungen diagnostischer Verfahren mit verbesserter Sensitivität, d. h. herabgesetzten unteren Nachweisgrenzen. Beispiele sind die FLOTAC- und die Mini-FLOTAC-Methode mit einer hohen Sensitivität von 1 bzw. 5 MDS-EPG sowie einer quantitativen Beurteilung ausgeschiedener Wurmeier.
Kotkulturen von Strongylideneiern zur Anzucht von dritten Larvenstadien (L3) können mit Hilfe von Plastikbechern oder Glasgefäßen durchgeführt werden. Die Kotproben werden bei Temperaturen von 25–27 °C und einer relativen Feuchtigkeit von 80–100 % inkubiert. Nach 14 Tagen können die L3 anhand morphologischer Merkmale unter Verwendung entsprechender Schlüssel aus der Literatur auf Gattungs- bzw. Speziesebene bestimmt werden.
Für den Nachweis von Bandwurmeiern wird eine kombinierte Sedimentation/Flotation mit zwei Zentrifugationsschritten unter Verwendung von Zuckerlösungen beschrieben (eine Flotationstechnik mit deutlich verbesserter Sensitivität im Vergleich zu Standard-Flotationsmethoden). Darüber hinaus kann eine Bandwurmexposition mit A. perfoliata auch mit Hilfe eines serologischen ELISA und neuerdings auch mit einem speichelbasierten ELISA untersucht werden (siehe auch S. 23). Sie eignen sich aufgrund ihrer im Vergleich zur koproskopischen Untersuchung deutlich höheren Sensitivität besser für die Identifizierung behandlungsbedürftiger Pferde und könnten so auch eine selektive Entwurmung zur Kontrolle von Bandwurminfektionen ermöglichen. Im Allgemeinen werden von jedem Pferd wiederholte Kotprobenuntersuchungen im Lauf eines Jahres empfohlen (siehe Tabellen 3-5). Wo solche individuellen Untersuchungen nicht möglich sind (aus praktischen oder ökonomischen Gründen), sollten wiederholte Analysen von Sammelkotproben von bis zu fünf Pferden derselben Altersgruppe durchgeführt werden, um das Gesamtspektrum des in den jeweiligen Pferdegruppen herrschenden Wurmbefalls zu überwachen und eine qualitative Beurteilung vornehmen zu können (z. B. die Zusammensetzung der im Betrieb vorhandenen Parasitenspezies).
Der Eizahlreduktionstest (EZRT) ist die einzige zurzeit verfügbare etablierte Methode für die Analyse der anthelminthischen Empfindlichkeit equiner Wurmpopulationen im Feld. Es handelt sich um einen einfachen Test für die Beurteilung der Wirksamkeit sämtlicher nematozider Arzneimittelklassen gegen Strongyliden- und Parascaris spp.-Populationen. Im Prinzip kann dieser Test auch zur Beurteilung der Wirksamkeit von Anthelminthika gegen andere Parasiten wie Leberegel oder Lungenwürmer herangezogen werden, bei Pferden ist diese Anwendung bislang aber noch nicht etabliert. Für andere Spezies wie Pfriemenschwänze und Bandwürmer ist dieser Test aufgrund der unregelmäßigen Ausscheidung von Eiern dagegen weniger aussagekräftig. Wo ein vollständiger EZRT nicht möglich ist (z. B. aus praktischen oder ökonomischen Gründen), wird dringend empfohlen, die Wirksamkeit von Anthelminthika regelmäßig mit Hilfe von Untersuchungen von Sammelkotproben nach erfolgter Entwurmung zu überwachen (einmal pro Arzneimittelklasse innerhalb von drei Jahren).
Weitere Angaben zu den folgenden Parasitenspezies finden Sie in der Download-Version der Empfehlung: Großer Leberegel (Fasciola hepatica), Lungenwurm (Dictyocaulus arnfieldi) und Magenwürmer (Trichostrongylus axei, Habronema spp. und Draschia megastoma).
Bildnachweis:
ESCCAP bedankt sich bei folgenden Institutionen und Personen für die Genehmigung der Reproduktion von Abbildungen:
Stand: August 2019
© ESCCAP Deutschland
