Unsere Partner
© ESCCAP Deutschland
Ein Parasiten- oder Pilzbefall kann nicht nur bei größeren Säugetieren, sondern auch bei Kleinsäugern schwere Krankheiten und Leiden verursachen. Die vorliegenden Empfehlungen geben einen Überblick über häufige oder bedeutsame Parasiten und Pilze, die bei als Heimtiere gehaltenen Kleinsäugern in Deutschland und angrenzenden Ländern auftreten können. Die von diesen Erregern für Wirtstiere und TierhalterInnen ausgehenden Risiken werden besprochen sowie praktikable Maßnahmen zur Behandlung und Prävention vorgestellt.
Die Liste der in den Empfehlungen genannten Parasiten und Mykosen ist nicht erschöpfend, enthält aber die am häufigsten in Mitteleuropa auftretenden und klinisch bedeutsamsten Erreger.
Es gibt nur wenige Substanzen, die in Deutschland zur Behandlung von Parasitosen oder Mykosen bei Kleinsäugern zugelassen und erhältlich sind. Da somit in der Regel ein Therapienotstand besteht, sind entsprechende Arzneimittel gemäß den arzneimittelrechtlichen Vorschriften über die Umwidmungskaskade anzuwenden („Off-Label-Anwendung“). Dabei ist bei Kleinnagern die Anwendung von Medikamenten nach § 60 Arzneimittelgesetz vereinfacht.
Sofern ein zoonotisches Risiko besteht, wird dies im Text angesprochen. Grundsätzlich ist eine Exposition der TierhalterInnen gegenüber potenziell mit Zoonose-Erregern infizierten Heimtieren oder der mit diesen kontaminierten Umgebung durch entsprechende Maßnahmen zu begrenzen. Immungeschwächte oder an bestimmten Krankheiten leidende Personen sollten über etwaige Gesundheitsrisiken, die von Zoonose-Erregern ausgehen könnten, durch die Tierärztin/den Tierarzt aufgeklärt werden.
Informationen über verfügbare Publikationen oder Fachbücher zu Parasitosen oder Mykosen bei kleinen Heimtieren sind über ESCCAP Deutschland zu erhalten.
Jede Tierart sowie jedes Tier benötigt eine auf ihre/seine individuellen Bedürfnisse zugeschnittene Haltung und Pflege. Manche der folgenden Faktoren können eine intensivere Behandlung oder Überwachung erfordern als andere.
Art, Alter, Herkunft, Anamnese und der gegenwärtige Gesundheitszustand des Heimtieres sind wichtige Informationen, die es zu berücksichtigen gilt. Manche Heimtierarten sind für bestimmte Erkrankungen anfälliger als andere. Bestimmte (Begleit-)Infektionen sind prädisponierend für Parasiten- oder Pilzbefall oder verschlimmern die Krankheitssymptome.
In Gruppen oder im Freigehege gehaltene Tiere haben möglicherweise ein höheres Infektionsrisiko als Einzeltiere bzw. Tiere, die reine Wohnungstiere sind. Bei gemeinsamer Haltung von Kleinsäugern und anderen Tieren (z. B. Hund, Katze) im Haushalt kann es zu einer wechselseitigen Übertragung bestimmter Parasiten- und Hautpilzarten kommen. Käfiggröße und Einstreu sollten für die jeweilige Tierart angemessen und von guter Qualität sein. Kleinsäuger sollten stets in einem gut belüfteten, trockenen und zugfreien Bereich gehalten werden und vor extremen Temperaturen geschützt sein.
Ein guter Hygienestandard sollte bei der Tierhaltung selbstverständlich sein. Käfige oder Boxen sind sauber zu halten und mit Kot oder Urin verunreinigte Einstreu ist zu wechseln, um das Risiko von (Re-)Infektionen gering zu halten. Ebenso sind Futter- und Trinkgefäße regelmäßig zu reinigen; täglich sollte frisches Trinkwasser angeboten werden. Kleine Heimtiere können, falls sie unhygienisch gehalten werden, von Fliegenmadenbefall betroffen sein.
Eine schlechte oder nicht artspezifische Ernährung kann dazu führen, dass Heimtiere für Parasiten oder Pilzbefall und für deren Auswirkungen anfällig werden. Qualitativ hochwertige Nahrung einschließlich potenziell notwendiger Vitamin- und Mineralstoffergänzung wird bei erkrankten Tieren als die Genesung unterstützend angesehen.
Das Übertragungsrisiko kann von örtlichen Gegebenheiten abhängen; beispielsweise kommen einige Parasitenarten endemisch in bestimmten Regionen vor, in anderen aber nicht. Besondere Vorsicht ist geboten, wenn Heimtiere während des Urlaubs in ein Endemiegebiet mitgenommen, zeitweilig in einer Tierpension untergebracht oder auf Ausstellungen präsentiert werden.
Dieses Kapitel betrifft nur Kaninchen, die als Hobbytiere gehalten werden. Es befasst sich nicht mit Kaninchen, die der Lebensmittelgewinnung dienen sollen, da bei diesen Tieren besondere rechtliche Vorschriften bezüglich Haltung und Arzneimittelanwendung zu beachten sind.
ENDOPARASITEN
Bei Kaninchen können prinzipiell verschiedenste Wurmarten auftreten, wobei diese dann zumeist im Magen-Darm-Trakt zu finden sind.
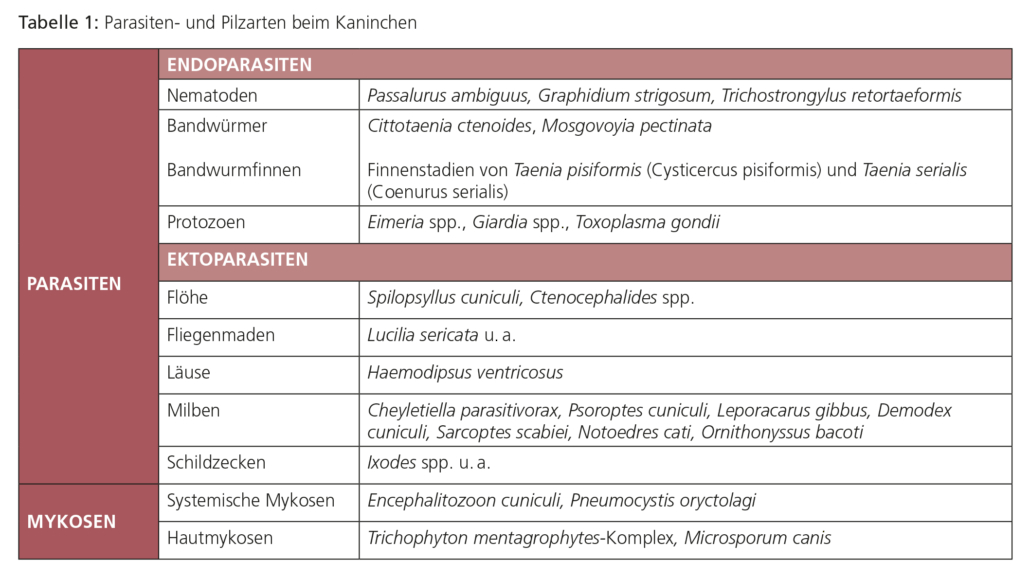
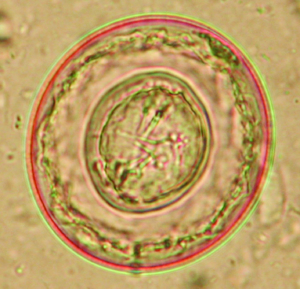
Der am häufigsten bei Hauskaninchen vorkommende Nematode ist Passalurus ambiguus („Pfriemenschwanz“ oder „Madenwurm“). Er parasitiert im Zäkum und Kolon. Geschlechtsreife Stadien sind etwa 0,5–1 cm lang; weibliche Exemplare sind am dünn und lang ausgezogenen Hinterende erkennbar. Ein hochgradiger Befall kann Juckreiz am Anus, Rektalprolaps, vermehrte Unruhe und bei Jungtieren reduzierte Gewichtszunahme verursachen, jedoch verläuft der Befall meist inapparent. Die Diagnose wird durch den Nachweis der typischen Eier (Abb. 1) mittels Perianalabklatsch (Klebestreifenmethode) oder Kotuntersuchung gestellt. Die Eier sind wie bei den meisten Pfriemenschwanzarten asymetrisch und mit einer Polkappe ausgestattet.
Abb. 1: Ei von Passalurus ambiguus (ca. 100 μm lang) sowie Oozysten von Eimeria spp.
Adulte Bandwürmer (Cittotaenia ctenoides, Mosgovoyia pectinata u. a. Arten) sind bei Wildkaninchen im Dünndarm recht häufig anzutreffen. Dagegen tritt Bandwurmbefall bei Hauskaninchen nur sehr selten und dann i. d. R. in Freigehegen auf. Grund dafür ist der indirekte Lebenszyklus der Bandwürmer, in dem Moosmilben als Zwischenwirte eingeschaltet sind. Der Befall bleibt asymptomatisch.
Diese kaninchenspezifischen Bandwürmer haben keine zoonotische Bedeutung.
Hauskaninchen sind gelegentlich Zwischenwirte für einige Bandwurmarten von Fleischfressern und beherbergen Finnen. Dies kann vor allem bei Freilandhaltung auftreten. Kaninchen infizieren sich dort durch Aufnahme von Bandwurmeiern, die von Endwirten (z. B. Katze, Fuchs, Hund) mit dem Kot ausgeschieden wurden. Dies kann auch bei Hobbytieren passieren, wenn sie mit frischem Grün gefüttert werden. Die Cysticercus pisiformis genannten Finnen der Taenia pisiformis finden sich als kleine Bläschen meist subserös in Leber, Netz oder Gekröse. Die Coenurus serialis genannten Finnen der Taenia serialis sind im Muskel- oder Unterhautgewebe, vereinzelt auch retrobulbär zu finden. In der Regel verursachen Finnen keine gesundheitlichen Probleme. Bei einem Befall der Orbita können sie chirurgisch entfernt werden.
Ein Infektionsrisiko durch betroffene Kaninchen besteht für TierhalterInnen nicht.
Eimerien zählen zu den am häufigsten nachzuweisenden Endoparasiten der (Haus-)Kaninchen. Mehrere Eimeria-Arten sind bekannt, wobei E. intestinalis und E. flavescens die pathogensten Arten sind und bei massiver Infektion eine Darmkokzidiose verursachen (traditionell wird eine Eimeria-Infektion als „Kokzidiose“ bezeichnet). Die Art Eimeria stiedai befällt das Gallengangsepithel und führt zur Leberkokzidiose. Kaninchen infizieren sich durch orale Aufnahme der umweltresistenten Oozysten, die zuvor von infizierten Tieren mit dem Kot ausgeschieden wurden und in der Außenwelt binnen weniger Tage Ansteckungsreife erreichten.
Eimeria-Arten des Kaninchens sind wirtsspezifisch; sie können also nur Kaninchen, nicht aber andere Tierarten infizieren und haben auch keine zoonotische Bedeutung.
Bei einzeln gehaltenen Hauskaninchen spielt die Kokzidiose kaum eine Rolle. Klinisch verlaufende Kokzidiosen werden fast nur bei Kaninchen beobachtet, die in Gruppen und unter unhygienischen Bedingungen gehalten werden, denn diese Bedingungen begünstigen starke Infektionen. Vor allem Jungtiere sind betroffen. Eine Initialinfektion führt i. d. R. zu einer Immunität, die vor klinischen Auswirkungen weiterer Ansteckung mit derselben Eimeria-Art schützt.
Eine Darmkokzidiose kann zu Verdauungsstörungen (wässriger Durchfall, auch Obstipation, Tympanie), Fressunlust und Gewichtsverlust führen. Sie ist meist eine Faktorenkrankheit; eine gleichzeitige Infektion mit bakteriellen oder viralen Erregern verschlimmert die Symptomatik. Die Leberkokzidiose verursacht ein ähnliches Krankheitsbild, allerdings kann es auch zu Ikterus, Hepatomegalie und Aszites kommen. Insgesamt hängen das Auftreten und die Schwere einer Erkrankung von der Eimeria-Art, der Infektionsstärke, dem Immunstatus des betroffenen Tieres sowie Begleitkeimen ab.
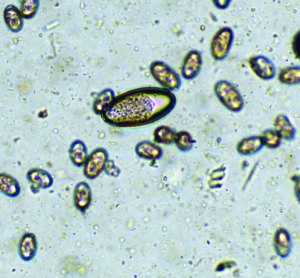
Die Diagnose eines Eimeria-Befalls erfolgt mittels Kotuntersuchung durch mikroskopischen Nachweis von Oozysten (Abb. 2). Ungeübte Untersucher verwechseln Eimeria-Oozysten bisweilen mit den sehr häufig und in großer Zahl im Kaninchenkot anzutreffenden Sporen des apathogenen Hefepilzes Cyniclomyces guttulatus (Saccharomycopsis guttulata) (Abb. 3). Es sei betont, dass ein alleiniger Oozystennachweis nicht beweist, dass Verdauungsstörungen durch die Eimeria-Infektion verursacht wurden oder werden.
Gelegentlich werden im Kot von Hauskaninchen Giardia-Zysten (8–10 μm) gefunden, doch gibt es keine Hinweise für eine klinische Bedeutung dieses Dünndarmflagellaten.
Die zoonotische Bedeutung der bei Kaninchen vorkommenden Giardia-Genotypen ist bislang unklar.
Kaninchen können wie andere Säugetierarten als Zwischenwirte für Toxoplasma gondii dienen. Die Infektion verläuft üblicherweise latent, selten führt sie zu einer systemischen Erkrankung mit Fieber, Pneumonie oder auch zentralnervösen Störungen.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Kaninchen kein Ansteckungsrisiko.
Abb. 2: Eimeria-Oozyste, hier von Eimeria intestinalis (27 x 18 μm groß)
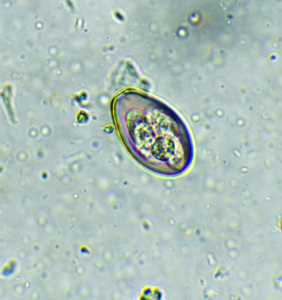
Abb. 3: Sporen des Hefepilzes Cyniclomyces guttulatus (Saccharomycopsis guttulata) (8–10 μm lang, zigarrenförmig)
EKTOPARASITEN
Ein Befall mit Spilopsyllus cuniculi (europäischer Kaninchenfloh) wird bei Wildkaninchen häufig angetroffen, ist aber bei Hauskaninchen sehr selten und nur in Freigehegen mit Kontakt zu Wildkaninchen denkbar. Diese wirtsspezifischen Flöhe befallen vor allem die Ohrmuscheln und sind u. a. Vektoren des Myxomatose-Virus.
Dagegen sind Hauskaninchen gelegentlich mit Hunde- und Katzenflöhen (Ctenocephalides spp.) befallen, insbesondere dann, wenn im Haushalt auch Hunde oder Katzen leben. Diese Flöhe können sich überall im Fell des Wirtstieres befinden; stärkerer Befall verursacht Hautreaktionen und erhebliche Unruhe. Die Diagnose eines Flohbefalls basiert auf dem Nachweis von Flöhen oder Flohkot, beispielsweise durch Verwendung eines Flohkamms.
Maden (Larven) von Schmeißfliegen, z. B. von der metallischgrünen Goldfliege Lucilia sericata, können bei Hauskaninchen während der warmen Sommermonate eine Myiasis verursachen. Die Fliegenweibchen werden durch kot- oder urinverschmutztes Fell angelockt. Sie legen dort oder in kleine bestehende Hautwunden ihre Eier ab. Die aus den Eiern geschlüpften Maden dringen in die Unterhaut ein und verursachen zum Teil großflächige und tiefe Wunden. Betroffene Kaninchen werden schnell apathisch und bei nicht unverzüglich behandeltem, hochgradigem Madenbefall kommen Todesfälle vor. Die Diagnose erfolgt adspektorisch durch Madennachweis in den Hautwunden.
Ein Befall mit der wirtspezifischen Lausart Haemodipsus ventricosus kommt bei Hauskaninchen nur selten vor. Starker Lausbefall, der u. a. zu hochgradigem Juckreiz, Haarverlust und Anämie führt, deutet auf eine verwahrloste Tierhaltung hin. Die Diagnose basiert auf dem Nachweis der Läuse oder Nissen im Fell.
Ein Befall mit Pelzmilben der Arten Cheyletiella parasitivorax und Listrophorus gibbus ist bei Hauskaninchen recht häufig festzustellen. Er verläuft i. d. R. symptomlos; allerdings kann starker Cheyletiella-Befall zu Alopezie und schuppiger Dermatitis führen. Die relativ großen Milben (ca. 500 μm) sind mit bloßem Auge als „wandernde Schuppen“ im Fell sichtbar oder lassen sich im Klebestreifenpräparat nachweisen (Abb. 4).
Cheyletiella parasitivorax ist beim Umgang mit betroffenen Tieren auf Menschen übertragbar und verursacht dann eine juckende Dermatitis.
Psoroptes cuniculi ist eine heutzutage selten bei Hobbytieren anzutreffende Räudemilbe, deren Prädilektionsstellen der Ohrgrund und die Ohrmuscheln sind. Massenbefall verursacht eine exsudative, borkig-krustöse Dermatitis (Ohrräude; Abb. 5), starken Juckreiz und bisweilen Kopfschiefhaltung. Bakterielle Sekundärinfektionen komplizieren das Krankheitsgeschehen. Das klinische Bild ist pathognomonisch; Psoroptes-Milben können im äußeren Gehörgang otoskopisch oder mikroskopisch im Ohrgeschabsel (KOH-Methode) nachgewiesen werden.
Psoroptes-Milben haben keine zoonotische Bedeutung.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) kommt originär bei Nagetieren vor (siehe Kapitel 2.a.), kann aber auch andere Säugetiere einschließlich Kaninchen befallen. Diese blutsaugenden, Juckreiz auslösenden Milben sind auf der Haut der Wirtstiere und in der Umgebung der Tiere (Einstreu, Käfigeinrichtungen) zu finden (siehe Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis.
Demodex cuniculi ist ein äußerst seltener Parasit der Hauskaninchen, der i. d. R. keine Symptome oder lediglich vermehrte Hautschuppenbildung verursacht.
Die Grabmilbenarten Sarcoptes scabiei und Notoedres cati kommen bei Kaninchen sehr selten vor, können dann aber eine Körperräude verursachen. Betroffene Tiere leiden unter Juckreiz und zeigen Hyperkeratose und schuppige Krusten an Kopf, Ohren und distalen Gliedmaßen.
Beide Arten sind Zoonose-Erreger und können beim Menschen eine juckende Krätze-ähnliche Hauterkrankung verursachen.
Befall mit Schildzecken (Ixodes spp.) tritt nur bei Kaninchen auf, die Auslauf im Freiland haben bzw. dort gehalten werden.
Abb. 4: Cheyletiella parasitivorax
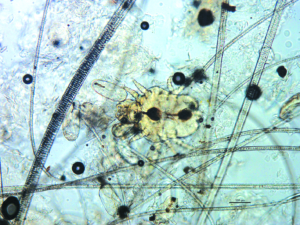
Abb. 5: Psoroptes-Räude bei einem Kaninchen
MYKOSEN
Encephalitozoon cuniculi ist ein intrazellulärer Erreger, der nach heutigem Kenntnisstand eng mit Pilzen verwandt ist. Die Ansteckung erfolgt oral über Sporen, die von infizierten Tieren mit dem Urin ausgeschieden wurden. Meist liegt eine latente Infektion vor. Die Encephalitozoonose kann bei Kaninchen aber altersunabhängig auch eine schwere, dann i. d. R. unbehandelt tödlich endende Erkrankung hervorrufen, wobei zentralnervöse Störungen (Kopfschiefhaltung, Ataxie, Lähmung; Abb. 6) vorherrschen; gelegentlich tritt eine phakoklastische Uveitis oder Niereninsuffizienz auf. Die Ätiologie des geschilderten Krankheitsbildes ist intra vitam meist schwierig festzustellen; klinische Symptome können zusammen mit dem serologischen Nachweis spezifischer Antikörper zu einer tentativen Diagnose führen. Der Nachweis von Sporen im Urin ist mittels Spezialfärbung oder PCR möglich, gelingt aber nicht zuverlässig.
Encephalitozoon cuniculi ist auf Menschen übertragbar und kann bei immungeschwächten Personen schwere Erkrankungen mit tödlichem Ausgang verursachen.
Pneumocystis oryctolagi und andere Pneumocystis-Arten besiedeln als Kommensale die Lungen von Kaninchen. Der Befall ist i. d. R. latent; bei immungeschwächten Tieren oder Jungtieren nach dem Absetzen wurde gelegentlich eine interstitielle Pneumonie beobachtet.
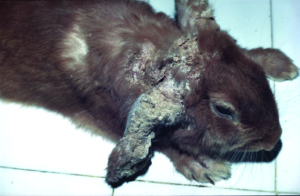
Die Ring- oder Glatzflechte der Kaninchen wird meist durch Hautpilze aus dem Trichophyton mentagrophytes-Komplex verursacht; Microsporum canis tritt nur selten auf. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. Besonders bei Jungtieren treten klinische Symptome auf, wobei kreisförmige, schorfige Alopezie-Areale im Kopfbereich typisch sind (Abb. 7), Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch den mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Diese Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Abb. 6: Kopfschiefhaltung bei einem Kaninchen mit Verdacht auf eine Encephalitozoon cuniculi-Infektion

Abb. 7: Glatzflechte (Trichophytie) bei einem jungen Kaninchen
In Deutschland existieren nur wenige Arzneimittel, die zum Einsatz bei Kaninchen zugelassen sind. Die Mehrzahl der Medikamente muss über die Umwidmungskaskade („Off-Label-Anwendung“) angewendet werden.
Zur Behandlung eines Befalls von Kaninchen mit Passalurus oder anderen Nematoden wird die fünftägige orale Anwendung von Fenbendazol in der Dosis von 20 mg/kg Körpergewicht/Tag empfohlen (Umwidmung); das Behandlungsregime ist gegebenenfalls nach 14 Tagen zu wiederholen. Zusätzlich sind die Boxen gründlich zu reinigen und zu desinfizieren.
Prinzipiell können auch andere, beispielsweise für Hund oder Katze zugelassene nematodizid wirkende Anthelminthika bei Kaninchen angewendet werden, wobei dann die jeweils für Hund/Katze empfohlene Dosis zu verwenden ist (Umwidmung).
Beim Vorliegen eines Bandwurmbefalls ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 10 mg/kg Körpergewicht oral verabreicht (Umwidmung); bei Bedarf erfolgt 10 Tagen später eine zweite Behandlung.
Sofern eine (metaphylaktische) Behandlung der Kokzidiose notwendig erscheint, kann zwischen mehreren Substanzen und Behandlungsregimen gewählt werden:
Zur Behandlung eines Flohbefalls bei Hauskaninchen ist Imidacloprid (1 x 10 mg/kg Spot-on) ein zugelassenes Präparat. Keinesfalls sollten wegen möglicher neurologischer Nebenwirkungen bis hin zu Todesfällen Phenylpyrazole (Fipronil, Pyriprol) bei Kaninchen angewendet werden. Zusätzlich ist es – wie in der Hunde- und Katzenhaltung – sinnvoll, die Umgebung mit einem Biozid (Insekten-Entwicklungshemmer) zu entwesen, um den Lebenszyklus der Flöhe dauerhaft zu unterbrechen.
Lausbefall beim Kaninchen kann mit Imidacloprid (s. o.) behandelt werden.
Gegen Pelzmilben oder Räudemilben sind nach Literaturangaben makrozyklische Laktone wie Ivermectin (2 x 0,2–0,4 mg/kg Körpergewicht subkutan in zweiwöchigem Abstand), Doramectin (1 x 0,2–0,3 mg/kg subkutan), Moxidectin (0,2– 0,3 mg/kg oral oder subkutan, Wiederholung nach 10 Tagen) oder Selamectin (s. o.) wirksam (jeweils Umwidmung). Psoroptes-Befall ist auch mit Fluralaner (1 x 25 mg/kg Körpergewicht oral; Umwidmung) erfolgreich zu bekämpfen. Bei schwerem Ohrmilbenbefall sollten zusätzlich Analgetika und ggf. Antibiotika (bei bakteriellen Sekundärinfektionen) verabreicht werden. Es empfiehlt sich, vor dem Akarizideinsatz die Ohren mit einem milden Antiseptikum zu reinigen und von überschüssigem Zerumen zu befreien. Keinesfalls sollten jedoch festhaftende Krusten und Beläge entfernt werden, da dies sehr schmerzhaft ist. Sämtliche Kontaktkaninchen sind in die Behandlung von Räude- und Pelzmilben einzubeziehen und die Umgebung der Tiere sollte gründlich dekontaminiert werden.
Die Therapie einer Wundmyiasis besteht in der mechanischen Entfernung der Fliegenmaden sowie anschließender Wundreinigung mit einem Antiseptikum. Nach Literaturangaben führt Nitenpyram (1 mg/kg Körpergewicht oral; Umwidmung) zu einer raschen Abtötung der Fliegenlarven. Es ist darauf zu achten, auch eine mögliche Grunderkrankung (Durchfall, Cystitis, Bissverletzungen) zu behandeln.
Zecken werden mit einer „Zeckenzange“ entfernt.
Zur Behandlung der Encephalitozoon-Infektion wird der Einsatz von Fenbendazol in der Tagesdosis von 20 mg/kg Körpergewicht oral über 4 Wochen empfohlen. Damit ist manchmal eine Linderung bestehender Krankheitssymptome zu erreichen; der Erreger wird aber i. d. R. nicht eliminiert. Bei neurologischen Symptomen wird zudem der Einsatz von Dexamethason empfohlen, um die lokale Entzündung einzudämmen. Auch Physiotherapie wird als wichtige Begleitmaßnahme angesehen.
Hautmykosen sind nicht einfach zu behandeln. Meist ist eine Kombination aus systemisch und topisch zu verabreichenden Antimykotika angezeigt. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral über 7 Tage; Umwidmung). Zur topischen Therapie stehen Enilconazol- und oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in den Bestand verbrachte Kaninchen zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Von Kaninchen genutzte Grünflächen sind vor Hunden, Katzen und Füchsen zu sichern. Auch sollte kein Grünfutter von Wiesen verfüttert werden, zu denen Wildkaninchen Zugang haben. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid zu medikieren, um etwaigem Finnenbefall bei Kaninchen vorzubeugen, sowie gegen Flohbefall zu behandeln. Kaninchenkäfige und -gehege sind regelmäßig zu säubern, denn Haltung auf urindurchnässter, kotverschmutzter Einstreu ist ein prädisponierender Faktor für das Auftreten von Fliegenmadenbefall (Wundmyiasis).
In der Hobbyhaltung von einzelnen Kaninchen ist es unwahrscheinlich, dass Kokzidiose zu einem klinischen Problem wird. Regelmäßige tägliche Reinigung von Käfigen und Austausch von Einstreu helfen, die Umgebung vor der Kontamination mit Eimeria-Oozysten zu schützen.
Studienergebnisse deuteten darauf, dass einer Encephalitozoon-Infektion durch Verabreichung von Fenbendazol (20 mg/kg Körpergewicht/Tag oral über 7–14 Tage, viermal im Jahr; Umwidmung) vorgebeugt werden kann. Dieses Behandlungsregime kann für Kaninchen bei erhöhtem Infektionsrisiko (beispielsweise Teilnahme an Ausstellungen) sinnvoll sein. Vor einer noch längeren Dauer dieser Medikation wird gewarnt, da dies bei Kaninchen zur Knochenmarksuppression führen könnte.
Indem die Kaninchen in den Stall gebracht werden und ihr Fell sauber gehalten wird, können sie vor Schmeißfliegenbefall geschützt werden. Dies gilt vor allem in Zeiten mit warmem, feuchtem Wetter.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
ENDOPARASITEN
Ein Befall mit Pfriemenschwänzen (Syphacia muris, Aspiculuris tetraptera) tritt bei Ratten vor allem in konventioneller Gruppenhaltung nicht selten auf; er kommt aber beispielsweise nach Zukauf vom Züchter oder aus einer Zoohandlung auch bei Einzeltieren vor. Pfriemenschwänze parasitieren den Dickdarm und haben einen direkten Lebenszyklus. Adulte Syphacia sind je nach Geschlecht ca. 1,5–5 mm lang und haben ein lang und dünn ausgezogenes Hinterende, adulte Aspiculuris sind 2–5 mm lang haben ein stumpfkegliges Hinterende. Syphacia-Infektionen wurden gelegentlich für Juckreiz im Analbereich, Rektumprolaps sowie bei allgemein geschwächten Tieren für Gewichtseinbußen verantwortlich gemacht, jedoch ist der Befall i. d. R. selbst bei hoher Wurmbürde klinisch nicht auffällig. Die Diagnose erfolgt durch Einachweis mittels Analabklatsch (Klebestreifenmethode) oder Koproskopie. Die Pfriemenschwanzarten der Muriden haben keine zoonotische Bedeutung.
Ratten können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung nur selten vorkommt. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier, somit ist auch eine Autoinfektion möglich. Der Befall bleibt normalerweise inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8).
Rodentolepis nana ist ein Zoonose-Erreger, betroffene Tiere sind eine Infektionsquelle für Menschen, vor allem für Kinder.
Abb. 8: Ei von Hymenolepis sp. (ca. 60 x 80 μm groß, eine Sechshakenlarve enthaltend)
Im (Frisch-)Kot von Ratten und anderen Muriden vor allem aus Gruppenhaltung sind mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) häufig Stadien von Giardia spp., anderen Flagellatenarten oder Amöben mikroskopisch nachweisbar. Die Infektionen verlaufen i. d. R. subklinisch, können aber zu Durchfall und Abmagerung führen.
Diese Einzeller haben keine zoonotische Bedeutung.
Ratten sind Wirte für mehrere Eimeria-Arten (u. a. E. nieschulzi und E. miyairii im Dünndarm sowie E. separata im Zäkum). Bei Tieren in Hobbyhaltung sind diese Einzeller nur sporadisch anzutreffen und haben klinisch keine Bedeutung. Die Diagnose erfolgt durch koproskopischen Nachweis der Oozysten. Eimeria-Arten der Ratte sind wirtsspezifisch; sie können also nur Ratten, nicht aber andere Tierarten infizieren und haben auch keine zoonotische Bedeutung.
Ratten sind prinzipiell wie andere Säugerarten Zwischenwirte für Toxoplasma gondii und können sich beispielsweise durch Aufnahme sporulierter Oozysten aus Katzenkot anstecken. Die Infektion verläuft bei betroffenen Tieren üblicherweise latent.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Ratten kein Ansteckungsrisiko.
EKTOPARASITEN
Ratten in Hobbyhaltung sind, vor allem wenn im gleichen Haushalt Hunde oder Katzen leben, gelegentlich mit Hunde- und
Katzenflöhen (Ctenocephalides spp.) infestiert. Wenn Kontakt zu Wildratten besteht, ist auch ein Vorkommen des Europäischen Rattenflohs (Nosopsyllus fasciatus; Abb. 9) denkbar.
Flohinfestationen gehen mit stumpfem Fell, Alopezie und Juckreiz einher. Sekundäre bakterielle Infektionen, Hypersensitivität und Anämie können bei Massenbefall das klinische Bild verschlimmern.
Da Flöhe nicht wirtsspezifisch sind, können sie auch den Menschen befallen.
Abb. 9: Nosopsyllus fasciatus (Europäischer Rattenfloh)

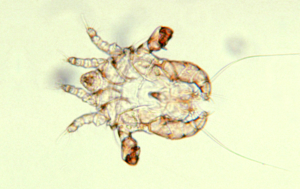
Lausbefall (Polyplax spinulosa) ist heutzutage bei Ratten in Hobbyhaltung eine Seltenheit. Jedoch können diese blutsaugenden Parasiten in Gruppenhaltung (z. B. beim Züchter oder in der Tierhandlung) und bei mangelhafter Pflege in großer Zahl auftreten und dann Juckreiz, Unruhe und Anämie verursachen. Die Diagnose ist leicht durch Nachweise der Läuse und Nissen im Fell zu stellen.
P. spinulosa ist – wie alle Tierläuse – streng wirtsspezifisch und somit nicht auf Menschen übertragbar.
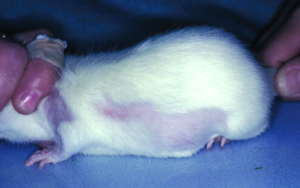
Die Tropische Rattenmilbe (Ornithonyssus bacoti) ist ein nicht selten bei Ratten und anderen Kleinsäugern vorkommender Ektoparasit. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis, sowie, selten, asthmatische Reaktionen z. B. bei Kindern.
Ein Befall mit wirtsspezifischen Pelzmilben (Radfordia ensifera) tritt bisweilen auch bei Ratten in Hobbyhaltung auf. Dann können Juckreiz und vermehrte Schuppenbildung vor allem in Kopf- und Schulterregion bestehen. Bakterielle Sekundärinfektionen und kratzbedingte Selbstverletzungen können das klinische Bild verschlimmern. Die Übertragung erfolgt durch Tier-zu-Tier-Kontakt. Pelzmilben sind durch die Klebestreifenmethode nachweisbar.
Eine zoonotische Bedeutung haben sie nicht.
Grabmilben der Arten Notoedres muris (Abb. 11) und Trixacarus diversus kommen manchmal bei Ratten in Hobbytierhaltung vor. Beide Arten führen vor allem im Kopfbereich zu warzenähnlichen oder krustösen Hautveränderungen mit hochgradigem Juckreiz (Abb. 12). Ein Nachweis dieser Räudemilben erfolgt mittels Hautgeschabsel (KOH-Methode).
Beide Grabmilbenarten sind auf Menschen übertragbar und verursachen dann eine juckende Krätze-ähnliche Hauterkrankung.
Schildzecken können im Freien gehaltene Ratten befallen. Diese Zecken heften sich während ihrer Blutmahlzeit für einige Tage an und fallen dann ab. Sie können mit einer Zeckenzange entfernt werden.
Abb. 10: Polyplax spinulosa (1–1,5 mm lang)
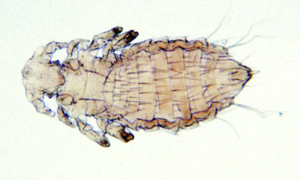
Abb. 11: Notoedres muris (ca. 0,4 mm groß)
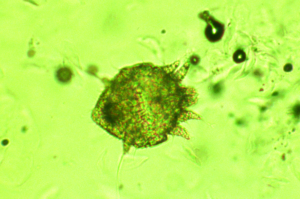
Abb. 12: Notoedres muris-Befall bei einer Ratte
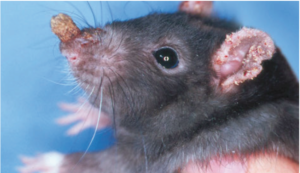
Abb. 13: Ornithonyssus bacoti (0,5–1 mm groß)

Pneumocystis spp. sind kommensale Bewohner der Lunge der meisten Nagetiere. Diese atypischen Pilzarten sind sehr wirtsspezifisch. Pneumocystis carinii und P. wakefieldiae sind bei Hausratten vorhanden. Eine sekundäre interstitielle Pneumonie kann auftreten, wenn die Tiere immunsupprimiert oder aufgrund einer gleichzeitigen Erkrankung geschwächt sind. HAUTMYKOSEN Ratten können mit Hautpilzen des Trichophyton mentagrophytes-Komplexes infiziert sein. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. In den meisten Fällen bleiben die Tiere asymptomatisch, sind aber prinzipiell eine Infektionsquelle für andere Tiere und den Menschen. Vorhandene Hautläsionen sind typisch und zeigen sich als kreisförmige oder diffuse Alopezie an Kopf, Hals oder Schwanz („Glatzflechte“; Abb. 14); Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22). Diese Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren. Abb. 14: Glatzflechte (Trichophytie) bei einer Ratte
Medikamente, die zur Behandlung von Parasitosen und Mykosen bei Ratten und anderen Nagern eingesetzt werden sollen, bedürfen in Deutschland nach § 60 AMG keiner Zulassung. Jedoch stehen keine Medikamente zur Verfügung, so dass Präparate umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Gegen Pfriemenschwanzbefall bei Ratten wurden verschiedene Wirkstoffe und Behandlungsprotokolle (jeweils Umwidmung) angewendet, beispielsweise Fenbendazol (täglich 20 mg/kg Körpergewicht direkt oral oder 100–150 mg/kg Futter jeweils an 5 aufeinanderfolgenden Tagen) und Ivermectin (täglich 3 mg/kg Körpergewicht an 4 Tagen übers Trinkwasser). Dagegen erwiesen sich Selamectin (Spot-on) und Moxidectin (oral) gegen Syphacia als unwirksam.
Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Ratten mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Zur Behandlung von Flagellaten- oder Amöbeninfektionen bei Ratten kann versuchsweise der Einsatz von Metronidazol (2,5 mg/ml) oder Dimetridazol (1 mg/ml) jeweils über das Trinkwasser für 7–14 Tage erwogen werden. Metronidazol kann auch mit 10–40 mg/kg Körpergewicht 1x täglich direkt verabreicht werden (jeweils Umwidmung).
Ein Eimeria-Befall kann, sofern dies metaphylaktisch erforderlich erscheint, mit Amprolium (zweimal täglich jeweils 25 mg/kg Körpergewicht über 5–7 Tage oral) medikiert werden. Im Experiment erwies sich auch Toltrazuril (z. B. 10 mg/kg Körpergewicht/Tag an 3 Tagen mit jeweils 3 behandlungsfreien Tagen; Umwidmung) als wirksam. Weiterhin sind Sulfonamide (z. B. Sulfamerazin oder Sulfaquinoxalin, jeweils 1 mg/ml Trinkwasser täglich für 2–3 Wochen) möglich (jeweils Umwidmung).
Ein Flohbefall bei Ratten ist durch Anwendung von Fipronil (7,5 mg/kg Körpergewicht Spot-on) oder Imidacloprid (20 mg/kg Körpergewicht Spot-on) jeweils im monatlichen Abstand oder von Selamectin (15–30 mg/kg Körpergewicht Spot-on, Wiederholung nach 2 Wochen) zu beseitigen (jeweils Umwidmung). Zusätzlich ist es sinnvoll, die Umgebung mit einem Biozid (Insekten-Entwicklungshemmer) zu behandeln, um den Lebenszyklus der Flöhe dauerhaft zu unterbrechen.
Gute Behandlungsresultate (jeweils Umwidmung) gegen Lausbefall liegen nach topischer Anwendung von Selamectin oder Fipronil (jeweils ein Tropfen verfügbarer Formulierungen auf die Halshaut) sowie nach Ganzkörperbehandlung mit Fipronil-Spray vor. Ivermectin (0,2–0,4 mg/kg Körpergewicht subkutan oder oral dreimal im Abstand von je 7–14 Tage) führte zur Eradikation der Läuse. Auch Imidacloprid (topische Anwendung, Dosierung s. oben) dürfte wirksam sein.
Pelzmilbenbefall bei Ratten kann nach jeweiliger Umwidmung beispielsweise mit Ivermectin (0,2–0,4 mg/kg Körpergewicht oral oder subkutan, 2–3 x im Abstand von 1–2 Wochen) oder Moxidectin (0,5 mg/kg Körpergewicht Spot-on, 2x im Abstand von 10 Tagen) behandelt werden. Alternativ können Selamectin, Fipronil oder Permethrin topisch eingesetzt werden. Dabei müssen alle Tiere unabhängig vom klinischen Bild behandelt werden, um eine Eradikation der Milben zu erzielen. Für große Tierhaltungen kann Ivermectin über das Futter verabreicht werden.
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Alternativ können auch makrozyklische Laktone wie Ivermectin (0,2–0,4 mg/kg Körpergewicht oral) oder Selamectin (1 Tropfen aus der kleinsten verfügbaren Pipette mit 6 %iger Lösung topisch) verwendet werden (jeweils Umwidmung). Um die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
Zecken können durch die Anwendung von Fipronil (Spray) eliminiert werden oder mittels einer Zeckenzange entfernt werden.
HAUTMYKOSEN
Auch bei Ratten besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung (jeweils Umwidmung). Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in einen Rattenbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Ratten bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
ENDOPARASITEN
Ein Befall mit Pfriemenschwänzen (Syphacia obvelata, Aspiculuris tetraptera) tritt bei Mäusen vor allem in konventioneller Gruppenhaltung nicht selten auf; er kommt aber beispielsweise nach Zukauf vom Züchter oder aus einer Zoohandlung auch bei Einzeltieren vor. Pfriemenschwänze parasitieren den Dickdarm und haben einen direkten Lebenszyklus. Adulte Syphacia sind je nach Geschlecht ca. 1,5–5 mm lang und haben ein lang und dünn ausgezogenes Hinterende, adulte Aspiculuris sind 2–5 mm lang haben ein stumpfkegliges Hinterende. Syphacia-Infektionen wurden gelegentlich für Juckreiz im Analbereich, Rektumprolaps sowie bei allgemein geschwächten Tieren für Gewichtseinbußen verantwortlich gemacht, jedoch ist der Befall i. d. R. selbst bei hoher Wurmbürde klinisch nicht auffällig. Die Diagnose erfolgt durch Einachweis mittels Analabklatsch (Klebestreifenmethode) oder Koproskopie.
Die Pfriemenschwanzarten der Muriden haben keine zoonotische Bedeutung.
Mäuse können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung nur selten vorkommt. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier; somit ist auch eine Autoinfektion möglich. Der Befall bleibt inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8).
Konsequente Hygienemaßnahmen (Reinigung, Desinfektion) sind wichtig, um das Übertragungsrisiko zu verringern.
Rodentolepis nana ist ein Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen.
Im (Frisch-)Kot von Mäusen vor allem aus Gruppenhaltung sind mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) häufig Stadien von Giardia spp. oder Spironucleus (syn. Hexamita) muris mikroskopisch nachweisbar. Die Infektionen verlaufen i. d. R. subklinisch.
Diese Einzeller haben keine zoonotische Bedeutung.
Mäuse sind Wirte für mehrere Eimeria-Arten, u. a. die das Zäkum und Kolon parasitierende Art E. pragensis. Diese Art verursachte bei experimenteller Infektion blutigem Durchfall, Gewichtsverlust und Tod, jedoch sind Symptome bei Mäusen in Hobbyhaltung nicht bekannt. Die Diagnose erfolgt durch koproskopischen Nachweis der Oozysten.
Eimeria-Arten der Maus sind wirtsspezifisch; sie können also nur Mäuse, nicht aber andere Tierarten infizieren und haben auch keine zoonotische Bedeutung.
Mäuse sind prinzipiell wie andere Säugerarten Zwischenwirte für Toxoplasma gondii und können sich beispielsweise durch Aufnahme sporulierter Oozysten aus Katzenkot anstecken. Die Infektion verläuft bei betroffenen Tieren üblicherweise latent.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Mäusen kein Ansteckungsrisiko.
EKTOPARASITEN
Ektoparasitenbefall ist auch bei Mäusen in Hobbyhaltung recht häufig festzustellen.
Gelegentlich tritt bei Mäusen bei gemeinsamer Haltung mit Hunden oder Katzen Flohbefall (Ctenocephalides spp.) auf. Flohbefall geht mit stumpfem Fell, Alopezie und Juckreiz einher. Bakterielle Sekundärinfektion, dermale Hypersensitivität und Anämie sind häufige Komplikationen bei schwerer Infestation.
Die Lausart Polyplax serrata (Vektor der Rickettsienart Eperythrozoon coccoides = Erreger der murinen Eperythrozoonose) kommt bei Mäusen in Hobbyhaltung sehr selten vor und spielt daher kaum eine Rolle. Läuse und Nissen können leicht im Fell nachgewiesen werden.
Polyplax serrata ist streng wirtsspezifisch und somit nicht auf Menschen übertragbar.
Mäuse können gelegentlich auch in Hobbyhaltung Pelzmilben (Myobia musculi, Radfordia affinis, Myocoptes musculinus) beherbergen (Abb. 15 und 16). Diese perlweißen, ca. 0,3–0,5 mm großen Milben sind an der Haarbasis zu finden, wo sie auch ihre Eier ablegen. Die Übertragung erfolgt durch Tier-zu-Tier-Kontakt. Gesunde Mäuse tolerieren üblicherweise einen starken Befall ohne sichtbare klinische Anzeichen. Bei alten oder gestressten Tieren (z. B. während der Trächtigkeit) kann es aber zu Symptomen wie Juckreiz und vermehrter Schuppenbildung kommen; bakterielle Sekundärinfektionen und kratzbedingte Selbstverletzungen können das klinische Bild verschlimmern. Pelzmilben sind durch Klebestreifenmethode nachweisbar.
Eine zoonotische Bedeutung haben sie nicht.
Psorergates simplex besiedelt die Haarbälge von Mäusen und ist wirtspezifisch. Die kugelförmige Milbe kommt nicht selten in größeren Mäusegruppen vor. In der Regel besteht ein subklinischer Befall; gelegentlich wurde bei starker Infestation eine krustöse Dermatitis beobachtet.
Die der roten Vogelmilbe ähnliche sog. „Hausmausmilbe“ (Liponyssoides sanguineus) tritt bei wild lebenden Nagern auf; sie kann in sehr seltenen Fällen auf Menschen den Rickettsienpocken-Erreger (Rickettsia akari) übertragen.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) ist ein nicht selten auch bei Mäusen und anderen Kleinsäugern vorkommender Ektoparasit. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (siehe Abb. 13). Die Diagnosestellung erfordert den Nachweis der Milben, die eher in der Umgebung (z. B. Käfig, Einstreu, Ritzen) als auf der Haut des Wirtes gefunden werden.
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis sowie, selten (z. B. bei Kindern), asthmatische Reaktionen.
Abb. 15: Myobia musculi (0,3–0,5 mm groß)

Abb. 16: Myocoptes musculinus (ca. 0,3 mm groß)
Pneumocystis spp. sind kommensale Bewohner der Lunge der meisten Nagetiere. Diese atypischen Pilzarten sind hochgradig wirtsspezifisch, wie z. B. der an die Maus angepasste Pneumocystis murina. Eine sekundäre interstitielle Pneumonie kann auftreten, wenn ein Tier immunsupprimiert oder geschwächt ist.
HAUTMYKOSEN
Mäuse können gelegentlich mit Hautpilzen des Trichophyton mentagrophytes-Komplexes infiziert sein. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. In den meisten Fällen bleiben die Tiere asymptomatisch, sie stellen dann prinzipiell aber eine Infektionsquelle für andere Tiere und den Menschen dar. Vorhandene Hautläsionen sind typisch und zeigen sich als kreisförmige oder diffuse Alopezie an Kopf, Hals oder Schwanz („Glatzflechte“); Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Diese Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Medikamente, die zur Behandlung von Parasitosen und Mykosen bei Ratten und anderen Nagern eingesetzt werden sollen, bedürfen in Deutschland nach § 60 AMG keiner Zulassung. Jedoch stehen keine Medikamente zur Verfügung, so dass Präparate umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Zur Behandlung von Pfriemenschwanzbefall bei Mäusen wurden verschiedene Wirkstoffe und Behandlungsprotokolle (jeweils Umwidmung) angewendet, beispielsweise Fenbendazol (täglich 20–50 mg/kg Körpergewicht direkt oral oder 100–150 mg/kg Futter an jeweils 5 aufeinanderfolgenden Tagen) oder Ivermectin (4 mg/kg Körpergewicht an 4 Tagen übers Trinkwasser). Dagegen erwies sich Selamectin (Spot-on) gegen Syphacia als unwirksam. Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Mäusen mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 25 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Zur Behandlung von Flagellaten- oder Amöbeninfektionen bei Mäusen kann versuchsweise der Einsatz von Metronidazol (2,5 mg/ml) oder Dimetridazol (1 mg/ml) jeweils über das Trinkwasser für 5 Tage erwogen werden (jeweils Umwidmung).
Ein Eimeria-Befall kann, sofern dies metaphylaktisch erforderlich erscheint, mit Amprolium (zweimal täglich jeweils 25 mg/kg Körpergewicht über 5–7 Tage oral) medikiert werden. Im Experiment erwies sich auch Toltrazuril (z. B. 10 mg/kg Körpergewicht/Tag an 3 Tagen mit jeweils 3 behandlungsfreien Tagen dazwischen) als wirksam. Weiterhin sind Sulfonamide (z. B. Sulfamerazin, Sulfamethazin oder Sulfaquinoxalin, jeweils 1 mg/ml Trinkwasser täglich für 2–3 Wochen) möglich (alle genannten Wirkstoffe sind umzuwidmen).
Flohbefall bei Mäusen kann durch monatlich wiederholte Ganzkörpereinreibung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier einreiben; Tiere nicht direkt einsprühen) beseitigt werden. Alternativ stehen Imidacloprid (20 mg/kg Körpergewicht Spot-on) oder Selamectin (15–30 mg/kg Körpergewicht Spot-on) zur Verfügung (jeweils Umwidmung). Zusätzlich ist es sinnvoll, die Umgebung mit einem Biozid (Insekten-Entwicklungshemmer) zu behandeln, um den Lebenszyklus der Flöhe dauerhaft zu unterbrechen.
Zur Beseitigung eines Lausbefalls wird Ivermectin (0,2–0,4 mg/kg Körpergewicht subkutan oder oral zwei- bis dreimal im Abstand von je 1–2 Wochen) empfohlen. Auch die topische Anwendung von Fipronil, Imidacloprid oder Selamectin dürfte wirksam sein (jeweils Umwidmung).
Pelzmilbenbefall bei Mäusen kann durch Ganzkörperbehandlung mit Fipronil (siehe oben) begegnet werden. Bei Gruppenhaltung ist eine Eradikation nicht leicht zu erreichen. Dafür wurde unter anderem die sog. „Micro-dot“-Technik verwendet: Jeder Maus werden 5 μl einer 1%igen Ivermectin-Lösung auf die Haut zwischen den Schulterblättern zweimal im Abstand von 10 Tagen getropft. Auch Moxidectin (3 μl einer 1 %igen Lösung) und Selamectin (10 mg/kg Körpergewicht Spot-on) erwiesen sich als wirksam (jeweils Umwidmung).
Milbenbefall bei Mäusen kann anekdotischen Angaben zufolge verringert werden, wenn in der Einstreu und Nistmaterial Permethrin-getränkte Wattebäusche liegen.
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Alternativ kann Ivermectin (0,2–0,4 mg/kg Körpergewicht oral) appliziert werden (jeweils Umwidmung). Um die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
Auch bei Mäusen besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in einen Mausbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.

ENDOPARASITEN
Dentostomella translucida ist eine für Gerbils spezifische Pfriemenschwanzart, die in Gruppenhaltung nicht selten angetroffen wird. Wirtstiere infizieren sich durch orale Aufnahme embryonierter Eier von der Perianalregion oder aus kotkontaminiertem Futter oder Trinkwasser. Daneben ist auch eine retrograde Infektion beschrieben, wobei Larven aus Eiern in der Perianalregion schlüpfen und in Colon oder Zäkum einwandern. Eine klinische Bedeutung besitzt dieser 1–2 cm lange Nematode nicht.
Dentostomella hat keine zoonotische Bedeutung.
Sporadisch wurde bei Gerbils auch über Syphacia– oder Aspiculuris-Befall berichtet, wenn sie Kontakt mit Ratten oder Mäusen hatten (Weiteres siehe bei diesen Wirtstieren).
Gerbils können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung nur selten vorkommt. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier; so ist auch eine Autoinfektion möglich. Der Befall bleibt inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8).
Rodentolepis nana ist ein Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen.
Im (Frisch-)Kot von Gerbils sind häufig Zysten von Entamoeba muris oder Trophozoiten des Flagellaten Tritrichomonas caviae mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) mikroskopisch nachweisbar. Entamoeba muris wird regelmäßig bei Gerbils durch den Nachweis von Zysten bei koprologischen Untersuchungen beobachtet. Diese Einzeller haben keine zoonotische Bedeutung.
EKTOPARASITEN
Ektoparasiten sind bei Gerbils in Hobbyhaltung selten. Gelegentlich tritt bei gemeinsamer Haltung mit Hunden oder Katzen Flohbefall (Ctenocephalides spp.) auf.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) ist ein nicht selten bei Gerbils und anderen Kleinsäugern vorkommender Ektoparasit. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (siehe Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis, sowie, selten (z. B. in Kindern), asthmatische Reaktionen.
Hautmykosen werden bei Gerbils meist durch Microsporum-Arten (vor allem M. gypseum), seltener durch Trichophyton– Arten hervorgerufen. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. Innerhalb einer Tiergruppe kann sich die Infektion schnell ausbreiten; Jungtiere sind am anfälligsten. Meist sind keine Symptome vorhanden; vereinzelt sind typische Hautläsionen (kreisförmige Areale mit Alopezie, Erythem und Krustenbildung) im Kopfbereich zu finden („Glatzflechte“). Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Diese Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Medikamente, die zur Behandlung von Parasitosen und Mykosen bei Gerbils eingesetzt werden sollen, bedürfen in Deutschland nach § 60 AMG keiner Zulassung. Jedoch stehen keine Medikamente zur Verfügung, so dass Präparate umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Zur Behandlung eines Dentostomella-Befalls kann versuchsweise Fenbendazol (20 mg/kg Körpergewicht direkt oral oder 100–150 mg/kg Futter an jeweils 5 aufeinanderfolgenden Tagen, dies dreimal mit jeweils einer behandlungsfreien Woche) eingesetzt werden (Umwidmung). Außerdem kann Ivermectin in dem für Milben (s.u.) beschriebenen Behandlungsprotokoll eingesetzt werden. Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Gerbils mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Ein Flagellaten- oder Amöbenbefall bei Gerbils kann versuchsweise mit Metronidazol (25 mg/kg Körpergewicht/Tag oral über 5 Tage) behandelt werden (Umwidmung).
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen, Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Alternativ kann Ivermectin (0,2–0,4 mg/kg Körpergewicht oral) appliziert werden (jeweils Umwidmung). Um die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
Auch bei Gerbils besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt. Grundsätzlich sollten neue, in einen Gerbilbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
ENDOPARASITEN
Paraspidodera uncinata ist ein Meerschweinchen-spezifischer, ca. 1–2 cm langer Nematode des Zäkums. Ein Befall wird vor allem bei Tieren mit Gruppenhaltung und in Außengehegen festgestellt. Er wird, wenn überhaupt, als wenig pathogen angesehen. Die Infektion kann mittels üblicher Kotuntersuchung mikroskopisch durch Nachweis der typischen Eier diagnostiziert werden.
Paraspidodera uncinata besitzt keine zoonotische Bedeutung.
Meerschweinchen können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung nur selten vorkommt. Die Art misst 20–40 mm und hat einen einzigartigen Lebenszyklus. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier; somit ist auch eine Autoinfektion möglich. Der Befall bleibt inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8).
Rodentolepis nana ist ein Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen.
Im (Frisch-)Kot von Meerschweinchen sind mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) bisweilen Stadien von Flagellaten (Tritrichomonas caviae, Chilomastix spp. u. a.) oder von Entamoeba caviae mikroskopisch nachweisbar. Auch Zysten von Balantidium caviae wurden im Kot nachgewiesen. Die Infektionen verlaufen subklinisch.
Diese Einzeller haben keine zoonotische Bedeutung.
Gelegentlich ist bei Meerschweinchen in Hobbyhaltung eine Giardia-Infektion durch Koproantigen-Nachweis zu diagnostizieren. Die Trophozoiten dieses Flagellaten parasitieren den Dünndarm; mit dem Kot werden Zysten als exogene Dauerstadien ausgeschieden. Dieser Einzeller soll nach älteren Literaturangaben sporadisch für Verdauungsstörungen verantwortlich sein, doch wird er allgemein als kaum pathogen eingestuft.
Die zoonotische Bedeutung der bei Meerschweinchen vorkommenden Giardia-Genotypen ist bislang unklar.
Bei Meerschweinchen in Gruppenhaltung wurde gelegentlich Cryptosporidium wrairi nachgewiesen. Hierbei waren vor allem Jungtiere betroffen; infizierte Tiere zeigten u. a. Durchfall, schlechte Gewichtsentwicklung oder Rektumprolaps.
Bei einzeln gehaltenen Tieren in Hobbyhaltung kommt der Darmeinzeller nur selten vor. Die Diagnose kann mittels spezifischem Koproantigen-Test gestellt werden.
Diese Meerschweinchen-spezifische Cryptosporidium-Art hat nach derzeitigem Kenntnisstand keine zoonotische Bedeutung.
Eimeria caviae ist die einzige bei Meerschweinchen vorkommende Eimeria-Art. Sie parasitiert im Zäkum und Kolon. Wie bei anderen Eimeria-Arten sind i. d. R. Jungtiere betroffen. In Gruppenhaltung und bei schlechten Haltungsbedingungen kann es zu starker Infektion mit klinischen Symptomen (blutiger Durchfall, struppiges Haarkleid, Todesfälle) kommen. Die Diagnose erfolgt durch mikroskopischen Nachweis der Eimeria-Oozysten im Kot.
Eine zoonotische Bedeutung besteht nicht.
Meerschweinchen sind prinzipiell wie andere Säugerarten Zwischenwirte für Toxoplasma gondii und können sich beispielsweise durch Aufnahme sporulierter Oozysten aus Katzenkot anstecken. Die Infektion verläuft bei betroffenen Tieren üblicherweise latent. In seltenen Fällen kann sie bei z. B. immungeschwächten Tieren mit respiratorischen, neurologischen und anderen Symptomen verlaufen und letal enden.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Meerschweinchen kein Ansteckungsrisiko.
EKTOPARASITEN
Meerschweinchen sind anfällig für Ektoparasiten und Hautpilze.
Wenn Hunde oder Katzen in der Wohnung gehalten werden, kann ein Flohbefall (Ctenocephalides spp.) gelegentlich auch beim Meerschweinchen auftreten.
Abb. 17: Meerschweinchen mit weißen Nissen im Haarkleid

Bei Meerschweinchen kommen drei Haarlingsarten vor: Gliricola porcelli (ca. 1,5 mm lang, schlank), Gyroporus ovalis (ca. 1 mm lang) sowie Trimenopon hispidum (ca. 1,5–2 mm lang, recht breiter Kopf). Sie ernähren sich von Hautschuppen und Talgsekret. Die Übertragung erfolgt durch direkten Kontakt von Tier zu Tier. Bei vernachlässigter Haltung kann ein Massenbefall auftreten, der dann mit Juckreiz, Alopezie und schuppigen Hautläsionen vor allem im vorderen Körperbereich verbunden ist. Haarlinge und ihre Nissen sind mit bloßem Auge im Haarkleid sichtbar (Abb. 17).
Aufgrund ihrer Wirtsspezifität befallen sie keine anderen Tierarten und sind ohne zoonotische Bedeutung.
Die Pelzmilbe Chirodiscoides caviae (300–500 μm, stark entwickelte Vorderbeinpaare; Abb. 19) ist ein für Meerschweinchen spezifischer Parasit. Er legt seine Eier an die Haarschäfte ab. Häufig ist die Infestation inapparent, doch kann es bei geschwächten oder vorerkrankten Tieren zu starker Vermehrung der Milben kommen, was zu Unruhe, Alopezie, Schuppenbildung, Juckreiz und Selbstverletzungen führt. Die Milben werden mittels Klebestreifenmethode mikroskopisch nachgewiesen.
Eine zoonotische Bedeutung hat Chirodiscoides caviae nicht.
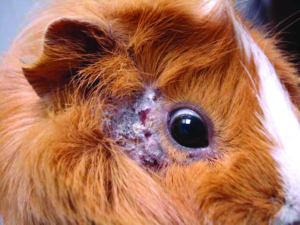
Die Grabmilbe Trixacarus caviae wird gelegentlich bei Meerschweinchen gefunden. Ihre Adultstadien sind ca. 150–200 μm groß (Abb. 20) und sitzen in der oberflächlichen Epidermis. Ein Befall wird bisweilen in Zuchtbeständen oder in Tierhandlungen festgestellt und kann dann beim Kauf eines Tieres in den Haushalt eingeschleppt werden. Die Übertragung erfolgt leicht durch direkten Kontakt von Tier zu Tier, aber auch indirekt durch kontaminierte Einstreu oder Pflegeutensilien.
Manchmal liegt ein subklinischer Befall vor. Symptome der klinischen Trixacarus-Räude sind hochgradiger Juckreiz, ständige Unruhe der Tiere und Hautverletzungen durch Kratzen, Alopezie (periokulär als „Augenbrille“ bezeichnet) sowie Hyper- und Parakeratose mit borkig-krustöser Dermatitis. Die klinische Verdachtsdiagnose wird durch mikroskopischen Milbennachweis im Hautgeschabsel (KOH-Methode) bestätigt.
Trixacarus ist wie andere Grabmilbenarten auf Menschen übertragbar und verursacht dann eine juckende Krätze-ähnliche Hauterkrankung vor allem an Händen, Armen und Brustregion. Allerdings wird der vollständige Lebenszyklus ausschließlich auf Meerschweinchen erreicht.
Demodex caviae ist wirtsspezifisch für Meerscheinchen. Die zigarrenförmige Milbe lebt in den Haarbälgen. Da ein Befall meist asymptomatisch auftritt, wird er nur selten registriert. Bei immungeschwächten, stark gestressten oder fehlernährten Tieren kann es aber zu einer Vermehrung der Milbenpopulation und folgend zu Symptomen wie Alopezie, erythrematöser Dermatitis mit Papel- und Krustenbildung kommen; manchmal besteht geringgradiger Juckreiz. In klinischen Fällen sind neben adulten Milben viele Jugendstadien und Eier im Hautgeschabsel nachweisbar.
Eine Übertragung auf Menschen ist nicht möglich.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) ist ein nicht selten bei Meerschweinchen und anderen Kleinsäugern vorkommender Ektoparasit. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (siehe Abb. 13).
Abb. 18: Gliricola porcelli (ca. 1,5 mm lang)
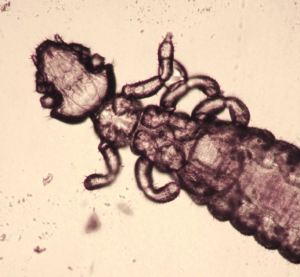
Abb. 19: Chirodiscoides caviae (ca. 400 μm groß)

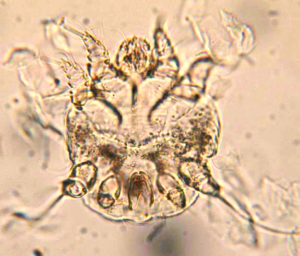
Abb. 20: Trixacarus caviae (ca. 200 μm groß)
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis sowie, selten (z. B. bei Kindern), asthmatische Reaktionen. Befall mit Schildzecken (Ixodes spp.) tritt bei Meerschweinchen nur auf, wenn sie Auslauf im Freiland haben oder dort gehalten werden. HAUTMYKOSEN Glatzflechte wird bei Meerschweinchen am häufigsten durch Pilze des Trichophyton mentagrophytes-Komplexes verursacht. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. Jungtiere sind besonders anfällig und zeigen eher klinische Symptome als ältere Tiere. Diese beginnen mit Haarbruch, später sind kreisförmige oder diffuse Alopezie-Areale am Kopf typisch („Glatzflechte“); in schweren Fällen kann der gesamte Körper betroffen sein (Abb. 23). Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22). Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Schildzecken
Abb. 21: Durch Trixacarus caviae verursachte Hautschäden
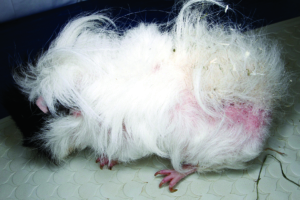
Abb. 22: Mikroskopisches Bild von Pilzen des Trichophyton mentagrophytes-Komplexes (Mikro- und Makrokonidien sowie Spiralhyphen)
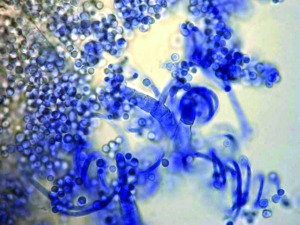
Abb. 23: Glatzflechte (Trichophytie) bei einem Meerschweinchen.
Zur Behandlung von Parasiten- und Pilzinfektionen bei Meerschweinchen stehen nur sehr wenige zugelassene Medikamente zur Verfügung, so dass Präparate i. d. R. umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Zur Behandlung eines Paraspidodera-Befalls eignen sich nach Literaturangaben Fenbendazol (tgl. 20 mg/kg Körpergewicht oral über 5 Tage) oder Levamisol (1 x 25 mg/kg Körpergewicht subkutan) (jeweils Umwidmung). Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Meerschweinchen mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Sofern eine Giardiose bei Meerschweinchen als behandlungswürdig angesehen wird, kann eine zweimal tägliche Behandlung über 5 Tage mit Fenbendazol (2 x 20–50 mg/kg Körpergewicht/Tag oral an 5 Tagen) oder alternativ mit Metronidazol (2 x 25 mg/kg Körpergewicht/Tag oral an 5–7 Tagen) versucht werden (jeweils Umwidmung).
Eimeria-Befall kann mit Amprolium (2 x 25 mg/kg Körpergewicht/Tag oral an 5–7 Tagen), Toltrazuril (10 mg/kg Körpergewicht/Tag oral an 3 Tage; Umwidmung) oder Sulfonamiden (z. B. Sulfadimethoxin, 40 mg/kg Körpergewicht/Tag an 5–7 Tagen; jeweils Umwidmung) erfolgen.
Zur Behandlung eines Flohbefalls beim Meerschweinchen wird Imidacloprid (20 mg/kg Körpergewicht Spot-on) oder Selamectin (20–30 mg/kg Körpergewicht Spot-on) empfohlen (jeweils Umwidmung).
Haarlingsbefall beim Meerschweinchen kann beispielsweise durch Ganzkörperbehandlung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier einreiben; Tiere nicht direkt einsprühen!) oder durch Applikation von Imidacloprid (20 mg/kg Körpergewicht Spot-on) oder Selamectin (15–30 mg/Tier (!) Spot-on) beseitigt werden (jeweils Umwidmung); die letztgenannten Arzneien sind direkt auf die Haut zu applizieren und die Behandlung ist nach 10 Tagen zu wiederholen.
Pelzmilbenbefall bei Meerschweinchen kann durch eine wenigstens zweimalige Ganzkörpereinreibung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier einreiben; Tiere nicht direkt einsprühen!) im Abstand von 10 Tagen behandelt werden. Daneben wurde u. a. das Selamectin (15–30 mg/Tier (!) Spot-on) empfohlen; diese Substanz muss direkt auf die Haut appliziert werden (jeweils Umwidmung).
Die Trixacarus-Räude kann beispielsweise durch Einsatz von Selamectin (15–30 mg/Tier (!) Spot-on), Ivermectin oder Doramectin (jeweils 0,2–0,4 mg/kg Körpergewicht subkutan) oder mit Imidacloprid/Moxidectin (0,05-0,1 ml/Tier einer 10%igen und 1%igen Spot-on-Lösung), Imidacloprid/Permethrin (0,1 ml/kg einer 10%igen und 50%igen Spot-on-Lösung) erfolgreich bekämpft werden, wenn die Medikation zwei- bis dreimal im Abstand von 7 Tagen wiederholt wird. Auch eine wiederholte Ganzkörpereinreibung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier einreiben; Tiere nicht direkt einsprühen) erwies sich als wirksam (jeweils Umwidmung). Neben der Behandlung der Meerschweinchen sollten auch deren Käfig und unmittelbare Umgebung mit Fipronil-Spray dekontaminiert werden.
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Alternativ kann Ivermectin (0,2–0,4 mg/kg Körpergewicht oral) appliziert werden (jeweils Umwidmung). Um die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
HAUTMYKOSEN
Zur Behandlung von Hautmykosen ist bei Meerschweinchen Miconazol zugelassen. Die Suspension ist zweimal am Tag dünn auf die betroffene Haut aufzutragen und gut einzureiben, wobei die Behandlung einige Tage über das völlige Verschwinden der Krankheitserscheinungen hinaus ununterbrochen fortgesetzt werden sollte. Bei hartnäckigen Fällen ist eine Behandlung von zwei bis drei Wochen notwendig. Falls erforderlich, sollte eine Therapie mit einem antimykotischen Präparat ohne Glukokortikoid angeschlossen werden. In solchen Fällen kann eine systemische Behandlung mit Itraconazol (2,5–10 mg/kg Körpergewicht oral) oder eine topische Behandlung mit Enilconazol (Waschlösung) erfolgen (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen.
In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden. Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in einen Meerschweinchenbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität
sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
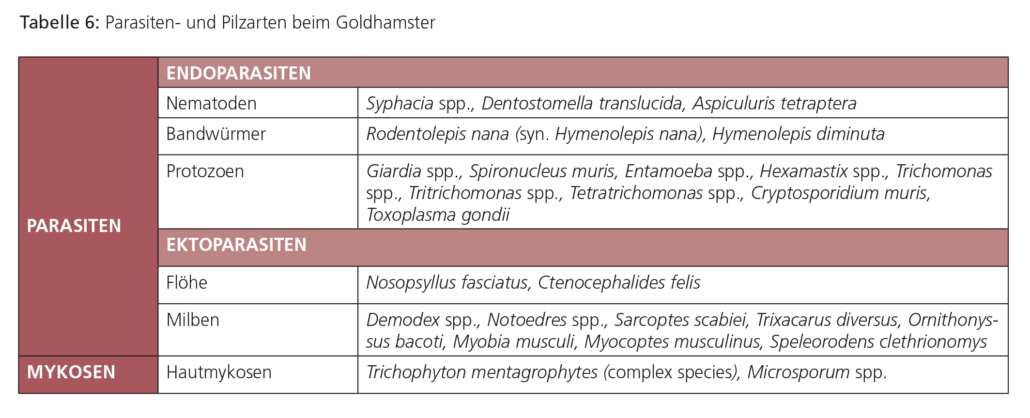
ENDOPARASITEN
Befall mit Pfriemenschwänzen (Syphacia spp.) kommt gelegentlich bei Goldhamstern in Hobbytierhaltung vor, beispielsweise nach Zukauf vom Züchter oder aus einer Zoohandlung. Pfriemenschwänze parasitieren im Dickdarm und haben einen direkten Lebenszyklus. Adulte Syphacia sind je nach Geschlecht ca. 1,5–5 mm lang und haben ein lang und dünn ausgezogenes Hinterende. Syphacia-Infektionen wurden gelegentlich für Juckreiz im Analbereich, Rektumprolaps sowie bei allgemein geschwächten Tieren für Gewichtseinbußen verantwortlich gemacht, jedoch ist der Befall i. d. R. selbst bei hoher Wurmbürde klinisch nicht auffällig. Aspiculuris tetraptera wurde in einigen neueren Untersuchungen ebenfalls gefunden. Die Diagnose erfolgt durch Einachweis mittels Analabklatsch (Klebestreifenmethode) oder Koproskopie.
Diese Pfriemenschwanzarten haben keine zoonotische Bedeutung.
Goldhamster können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung nur selten vorkommt. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich
Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier; somit ist auch eine Autoinfektion möglich. Der Befall bleibt inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8). Rodentolepis nana ist ein Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen.
Im (Frisch-)Kot von Goldhamstern vor allem aus kommerzieller Gruppenhaltung sind mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) häufig Stadien von Giardia spp., anderen Flagellaten (Spironucleus [syn. Hexamita] muris, Trichomonas spp. u. a.) oder Entamoeba sp. mikroskopisch
nachweisbar. Diese Darmprotozoen haben bei Tieren in Hobbyhaltung keine klinische Relevanz.
Diese Einzeller haben keine zoonotische Bedeutung.
Bei Goldhamstern auch aus Hobbyhaltung wurde sporadisch über Infektionen mit Cryptosporidium spp. berichtet. Eine Dünndarmentzündung kann bestehen. Die Diagnose kann beispielsweise durch Nachweis von spezifischem Koproantigen gestellt werden.
Die zoonotische Bedeutung der beim Hamster vorkommenden Genotypen ist bislang unklar.
Goldhamster sind prinzipiell wie andere Säugerarten Zwischenwirte für Toxoplasma gondii und können sich beispielsweise durch Aufnahme sporulierter Oozysten aus Katzenkot anstecken. Die Infektion verläuft bei betroffenen Tieren üblicherweise latent.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Hamstern kein Ansteckungsrisiko.
EKTOPARASITEN
Wenn Hunde oder Katzen in der Wohnung gehalten werden, kann ein Flohbefall (Ctenocephalides spp.) gelegentlich auch beim Goldhamster auftreten.
Goldhamster können gelegentlich Pelzmilben (Myobia musculi, Myocoptes musculinus; Abb. 15 und 16) beherbergen, wenn sie gemeinsam mit Mäusen gehalten werden. Diese perlweißen, ca. 0,3–0,5 mm großen Milben sind an der Haarbasis zu finden, wo sie auch ihre Eier ablegen. Die Übertragung
erfolgt durch Tier-zu-Tier-Kontakt. Gesunde Tiere tolerieren üblicherweise einen starken Befall ohne sichtbare klinische Anzeichen. Bei alten oder gestressten Tieren (z. B. während der Trächtigkeit) kann es aber zu Symptomen wie Juckreiz und vermehrter Schuppenbildung kommen; bakterielle
Sekundärinfektionen und kratzbedingte Selbstverletzungen können das klinische Bild verschlimmern. Pelzmilben sind durch Klebestreifenmethode nachweisbar.
Eine zoonotische Bedeutung haben sie nicht.
Über das Vorkommen von Grabmilben der Gattung Notoedres bei Goldhamstern aus Tierhandlungen liegen sporadisch Berichte vor. Trixacarus sp. wurde als weitere Grabmilbenart bei gemeinsamer Haltung von Hamstern mit Mäusen beobachtet. Diese Milben führen vor allem im Kopfbereich zu warzenähnlichen oder krustösen Hautveränderungen mit hochgradigem Juckreiz. Ihr Nachweis erfolgt mittels Hautgeschabsel (KOH-Methode).
Grabmilben sind auf Menschen übertragbar und verursachen dann eine juckende Krätze-ähnliche Hauterkrankung.
Demodex-Milben (D. aurati, D. criceti) sind die häufigsten Ektoparasiten des Goldhamsters. Sie sind wirtsspezifisch und parasitieren in den Haarbälgen. Jungtiere infizieren sich in der Säugeperiode initial am Muttertier. Meist liegt ein symptomloser Befall vor. Eine erythrematöse, schuppige Dermatitis mit
Alopezie kann auftreten, vor allem bei einer immunsupprimierenden Grunderkrankung (z. B. Morbus Cushing); Juckreiz besteht i. d. R. nicht. In klinischen Fällen sind neben den zigarrenförmigen adulten Milben (Abb. 24) viele Jugendstadien und Eier im Hautgeschabsel nachweisbar.
Ein naher Verwandter des syrischen Hamsters, der armenische Hamster (Cricetulus migratorius), hat eine spezifische Milbe, Demodex cricetuli, die D. aurati sehr ähnelt. Ausgewachsene Männchen sind ca. 173 μm und ausgewachsene Weibchen ca. 192 μm lang. Eine weitere Art, Demodex sinocricetuli,
kann im gestreiften Hamster (Cricetulus barabensis) beobachtet werden, der ihr natürlicher Wirt ist. Erwachsene Männchen messen etwa 112-128 μm in der Länge und erwachsene Weibchen etwa 127-150 μm. Diese beiden Arten befinden sich in den Haarfollikeln und können Läsionen und klinische
Anzeichen hervorrufen, die denen des syrischen oder goldenen Hamsters ähneln.
Eine Übertragung auf Menschen ist nicht möglich.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) ist ein nicht selten bei Goldhamstern und anderen Kleinsäugern vorkommender Ektoparasit. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (siehe Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis, sowie, z. B. bei Kindern, asthmatische Reaktionen.
HAUTMYKOSEN
Hautmykosen (Trichophyton mentagrophytes-Komplex, Microsporum spp.) sind bei Goldhamstern sehr selten. Die Ansteckung mit umweltresistenten Pilzsporen erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und auch bei der Pflege mit kontaminierten Utensilien. Klinische
Anzeichen sind kreisförmige oder diffuse, schuppig-krustöse Alopezie-Areale („Glatzflechte“); Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Abb. 24: Demodex criceti (ca. 100 μm lang, zigarrenförmig)
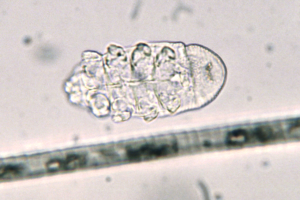
Medikamente, die zur Behandlung von Parasitosen und Mykosen bei Goldhamstern eingesetzt werden sollen, bedürfen in Deutschland nach § 60 AMG keiner Zulassung. Jedoch stehen keine Medikamente zur Verfügung, so dass Präparate umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Zur Behandlung eines Pfriemenschwanzbefalls beim Goldhamster wird Fenbendazol (20–50 mg/kg Körpergewicht/Tag direkt oral an 5 aufeinanderfolgenden Tagen) empfohlen (Umwidmung). Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Goldhamstern mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl bei allen kleinen Heimtieren. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Zur Behandlung der Giardiose beim Goldhamster kann versuchsweise Fenbendazol (20–50 mg/kg Körpergewicht/Tag oral an 7–10 Tagen) oder Metronidazol (2 x 20–40 mg/kg Körpergewicht/Tag oral an 14 Tagen) eingesetzt werden (jeweils Umwidmung). Allerdings wird eine Erregerelimination dadurch meist nicht erreicht. Gründliche Reinigung und Desinfektion von Käfigen, Wasser- und Futterschalen etc. sind empfehlenswert.
Zur Behandlung eines Flohbefalls beim Goldhamster wird die wiederholte Ganzkörpereinreibung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen) oder der in monatlichem Abstand erfolgende Einsatz von Imidacloprid (20 mg/kg Körpergewicht Spot-on) oder Selamectin (20–30 mg/kg Körpergewicht Spot-on) empfohlen (jeweils Umwidmung).
Zur Behandlung eines Pelzmilbenbefalls beim Goldhamster wird analog zu Mäusen die zweimalige Ganzkörperbehandlung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier einreiben; Tiere nicht direkt einsprühen) im Abstand von 10 Tagen empfohlen. Auch die
sog. „Micro-dot“-Technik soll wirken, wobei jedem Tier 5 μl einer 1%igen Ivermectin-Lösung auf die Haut zwischen den Schulterblättern zweimal im Abstand von 10 Tagen getropft werden (jeweils Umwidmung).
Ein Teil einer 1%igen Ivermectin-Lösung (10 mg/ml) sollte mit 10 Teilen Leitungswasser gemischt werden und einmal wöchentlich über drei Wochen gesprüht werden. Bitte beachten Sie, dass Ivermectin in Wasser schlecht löslich ist, daher wird die Verwendung eines Lipidträgers wie Propylenglykol empfohlen. Pro Tier sollte nicht mehr als 1 ml (der verdünnten Lösung) verabreicht werden. Bei großen Gruppen von Tieren kann Ivermectin über das Futter verabreicht werden. Bei Hamstern können auch Moxidectin (0,4 mg/kg Körpergewicht), Doramectin (0,2–0,4 mg/kg Körpergewicht) und Selamectin (15–30 mg/kg Körpergewicht) verwendet werden. Eine Eradikation bei Gruppenhaltung ist aber oft nicht zu erreichen.
Eine Notoedres-Räude beim Goldhamster ist bisher nicht sicher zu behandeln. Jedenfalls erwiesen sich der Einsatz von Ivermectin (0,4 mg/kg Körpergewicht subkutan) oder Moxidectin (0,4 mg/kg Körpergewicht oral; jeweils Umwidmung) jeweils mehrfach in wöchentlichem Abstand wiederholt als unzureichend wirksam.
Eine generalisierte Demodikose beim Goldhamster ist schwer zu behandeln. Durch Einsatz von Ivermectin (0,2–0,4 mg/kg Körpergewicht subkutan wiederholt in wöchentlichem Abstand oder 0,3 mg/kg Körpergewicht/Tag per os als mehrwöchige Dauertherapie), Moxidectin (0,4 mg/kg Körpergewicht
oral wiederholt in wöchentlichem Abstand) oder Selamectin (6–18 mg/kg Körpergewicht Spot-on in zweiwöchigem Abstand; jeweils Umwidmung) war die klinische Symptomatik wesentlich zu reduzieren, die Milbenpopulation jedoch nicht zu eliminieren. Letzteres soll nach neuesten Erkenntnissen mit
Fluralaner (2 x 25 mg/kg Körpergewicht oral im Abstand von 2 Monaten; Umwidmung) zu erreichen sein.
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil (Umwidmung) im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Alternativ wurde auch Selamectin (15–30 mg/kg Körpergewicht, oder 1 Tropfen im Nacken) angewendet. Um die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
HAUTMYKOSEN
Auch bei Goldhamstern besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und
oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien
etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt. Grundsätzlich sollten neue, in einen Goldhamsterbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
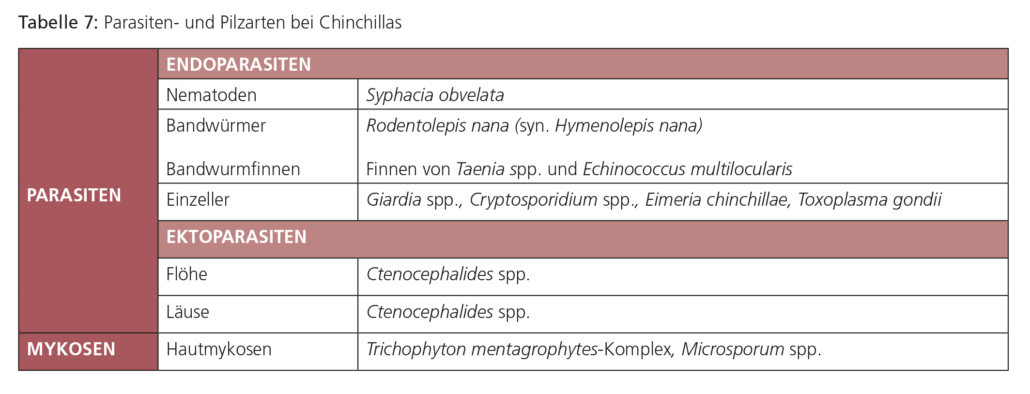
ENDOPARASITEN
Pfriemenschwanzbefall (Syphacia obvelata) wird nur selten beim Chinchilla festgestellt. Adulte Syphacia sind je nach Geschlecht ca. 1,5–5 mm lang und haben ein lang und dünn ausgezogenes Hinterende. Syphacia-Infektionen wurden gelegentlich für Juckreiz im Analbereich, Rektumprolaps sowie bei allgemein geschwächten Tieren für Gewichtseinbußen verantwortlich gemacht, jedoch ist der Befall i. d. R. selbst bei hoher Wurmbürde klinisch nicht auffällig. Die Diagnose erfolgt durch Einachweis mittels Analabklatsch (Klebestreifenmethode) oder Koproskopie.
Diese Pfriemenschwanzart hat keine zoonotische Bedeutung.
Chinchillas können wie andere Kleinnager Zwergbandwürmer (Rodentolepis [syn. Hymenolepis] nana, Hymenolepis diminuta) beherbergen, wobei dies in Hobbyhaltung selten vorkommt. Bei Rodentolepis nana besteht im Gegensatz zu allen anderen Bandwurmarten die Möglichkeit, dass sich Wirtstiere ohne Einschaltung eines Zwischenwirts direkt infizieren, nämlich durch Aufnahme fäkal ausgeschiedener Eier; somit ist auch eine Autoinfektion möglich. Der Befall bleibt inapparent. Die Diagnose erfolgt durch mikroskopische Kotuntersuchung und Nachweis der Bandwurmeier (siehe Abb. 8).
Rodentolepis nana ist ein Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen.
Infektionen mit Giardien sind außerordentlich häufig bei Chinchillas zu finden. Die Trophozoiten leben auf der Dünndarmschleimhaut. Mit dem Kot ausgeschiedene Zysten sind für wenige Wochen infektionsfähig und werden oral aufgenommen. In Chinchilla-Zuchten gelten Alttiere als Ansteckungsquelle für ihre Nachkommen. Starker Befall führt bei Jungtieren nach dem Absetzen zu Durchfall, struppigem Haarkleid und Kachexie; die Mortalität kann hoch sein. Die Diagnose erfolgt durch Nachweis von Giardia-Koproantigen oder mittels spezieller Technik (sog. SAF- Konzentrationsverfahren) mikroskopisch von Zysten im Kot. Die zoonotische Bedeutung der bei Chinchillas vorkommenden Giardia-Genotypen ist bislang unklar. Chinchillas sind prinzipiell wie andere Säugerarten Zwischenwirte für Toxoplasma gondii und können sich beispielsweise durch Aufnahme sporulierter Oozysten aus Katzenkot anstecken. Die Infektion verläuft bei betroffenen Tieren üblicherweise latent. Sporadisch wurde über neurologische Symptome (Koordinationsstörung, Torticollis u. a.) und Todesfälle berichtet; die Diagnose wird in solchen Fällen i. d. R. post mortem
gestellt.
Für TierhalterInnen besteht beim Kontakt mit Toxoplasma-infizierten Chinchillas kein Ansteckungsrisiko.
EKTOPARASITEN
Chinchillas besitzen ein sehr dichtes Haarkleid, womit das seltene Vorkommen von Ektoparasiten bei dieser Tierart begründet wird.
Sporadisch tritt bei Chinchillas in gemeinsamer Haltung mit Hunden oder Katzen Flohbefall (Ctenocephalides spp.) auf.
Die Tropische Rattenmilbe (Ornithonyssus bacoti) kann bei Chinchillas vorkommen. Sie wird beim Zukauf (z. B. aus einer Tierhandlung) eingeschleppt und kann dann aufgrund idealer Vermehrungsbedingungen innerhalb einer Wohnung zu einer Plage werden. Diese blutsaugenden Milben sind dämmerungsaktiv, wenig wirtsspezifisch und können daher auch andere Tiere im gleichen Haushalt befallen. Sie verursachen Juckreiz und unruhiges Verhalten der Tiere. Milbenstadien sind auf der Haut der Wirtstiere und in der Einstreu zu finden (siehe Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis, sowie, z. B. bei Kindern, asthmatische Reaktionen.
HAUTMYKOSEN
Glatzflechte (Trichophyton mentagrophytes-Komplex) kommt bei Chinchillas gelegentlich auch in Hobbyhaltung vor. Die Ansteckung mit umweltresistenten Pilzsporen erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und auch bei der Pflege mit kontaminierten Utensilien. Klinische Symptome sind kreisförmige oder diffuse, schuppig-krustöse Alopezie-Areale (Abb. 25); Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Abb. 25: Glatzflechte (Trichophyton mentagrophytes-Komplex) bei einem Chinchilla
Zur Behandlung von Parasiten- und Pilzinfektionen bei Chinchillas stehen nur sehr wenige zugelassene Medikamente zur Verfügung, so dass Präparate i. d. R. umgewidmet werden müssen („Off-Label-Anwendung“). Dabei besteht aufgrund der geringen Größe der Tiere und ihrer starken Putzaktivität bei topischer Anwendung ein erhöhtes Toxizitätsrisiko.
Nach Literaturangaben kann Pfriemenschwanzbefall bei Chinchillas beispielsweise durch Fenbendazol (20 mg/kg Körpergewicht/Tag oral an 5 aufeinanderfolgenden Tage im Futter; Umwidmung) beseitigt werden. Zusätzlich sind gründliche Säuberung und Desinfektion von Käfig, Futternäpfen etc. erforderlich, um Reinfektionen zu verhindern.
Infektionen von Chinchillas mit Bandwürmern, vor allem mit der zoonotischen Art Rodentolepis (syn. Hymenolepis) nana, sind behandlungswürdig. Dafür ist Praziquantel das Mittel der Wahl. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zwei- bis dreimal im Abstand von je 10–14 Tagen
subkutan oder oral verabreicht (Umwidmung).
Die Giardiose gehört zu den behandlungswürdigen Parasitosen der Chinchillas. Dafür wird der Einsatz von Fenbendazol (2 x 25–50 mg/kg Körpergewicht/Tag oral an 2–5 aufeinanderfolgenden Tage; Umwidmung) empfohlen. Metronidazol sollte bei Chinchillas wegen möglicher toxischer Effekte mit Vorsicht angewandt werden.
Zur Behandlung eines Flohbefalls beim Chinchilla wird die wiederholte Ganzkörpereinreibung mit Fipronil (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen) oder der in monatlichem Abstand
erfolgende Einsatz von Imidacloprid (20 mg/kg Körpergewicht Spot-on) oder Selamectin (6 mg/kg Körpergewicht Spot-on) empfohlen (jeweils Umwidmung).
Bei Ornithonyssus-Befall empfiehlt sich eine zweimalige Ganzkörperbehandlung mit Fipronil (Umwidmung) im Abstand von 10 Tagen (behandschuhte Hand mit Fipronil-Spray anfeuchten und damit das Tier unter Verschonung von Augen Maul und Ohr einreiben; Tiere nicht direkt einsprühen). Um
die Tropische Rattenmilbe aus einem Haushalt zu eliminieren, sind zusätzlich zwingend die gründliche Reinigung von Käfigen und Umgebung, Erneuerung der Einstreu und eine Umgebungsbehandlung mit einem akarizid wirkenden Biozid erforderlich. Bei Massenbefall kann es sogar notwendig werden, einen staatlich geprüften Schädlingsbekämpfer einzubestellen, um eine Eradikation zu erreichen.
HAUTMYKOSEN
Auch bei Chinchillas besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und oder
Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien
etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in einen Chinchillabestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
ENDOPARASITEN
Frettchen sind gelegentlich mit Adultstadien des Katzenspulwurms Toxocara cati oder sehr selten mit jenen des Hundespulwurms Toxocara canis befallen. Sie infizieren sich durch Aufnahme embryonierter Eier aus der Umwelt, möglicherweise auch durch Verzehr paratenischer Zwischenwirte (Kleinnager), die Spulwurmlarven beherbergen. Es folgt eine Leber-Lungenwanderung und Weiterentwicklung der Toxocara-Larven, die ca. 8 Wochen post infectionem mit dem Auftreten adulter, eiproduzierender Stadien im Dünndarm endet. Die fäkal ausgeschiedenen Toxocara-Eier benötigen einige Wochen bis zur Ansteckungsreife und sind dann in der Außenwelt jahrelang infektiös. Bei Frettchen besteht i. d. R. ein subklinischer Befall.
Toxocara spp. sind Zoonose-Erreger; betroffene Tiere sind eine Infektionsquelle für Menschen nach Reifung der Larve im Ei.
Frettchen können selten auch den Spulwurm Toxascaris leonina im Dünndarm beherbergen und dessen Eier mit dem Kot ausscheiden. Die Entwicklung vollzieht sich ohne Körperwanderung und dauert ca. 8 Wochen. Es liegt meist eine asymptomatische Infektion vor, sie können aber auch mit vergrößertem Abdomen, Erbrechen, Durchfall und Gewichtsverlust einher gehen. Anders als Toxocara spp. ist Toxascaris kein Zoonose-Erreger.
Toxocara– oder Toxascaris-Befall kommt aufgrund möglicher Kreuzübertragung bei Frettchen insbesondere dann vor, wenn sie gemeinsam mit Hunden oder Katzen gehalten werden. Embryonierte Toxocara-Eier können akzidentell von Menschen aufgenommen werden und dann das klinische Bild der Larva migrans visceralis hervorrufen (siehe dazu: ESCCAP-Empfehlung Nr. 1, Bekämpfung von Würmern (Helminthen) bei Hunden und Katzen).
Neben Hunden und Katzen sind auch Frettchen Endwirte von Dirofilaria immitis; sie können an der Herzwurminfektion schwer erkranken und sterben. D. immitis kommt autochthon in süd- und südosteuropäischen Regionen, bislang aber nicht nördlich der Alpen vor.
Frettchen sind genauso anfällig für Herzwurminfektionen wie Hunde, so dass sich erwachsene Würmer bei infizierten Tieren leicht etablieren können. Dies steht im Gegensatz zu Katzen, bei denen die Anzahl der sich etablierenden Würmer tendenziell gering ist. Da das Herz und die Gefäße eines Frettchens jedoch relativ klein sind, kann bereits eine geringe Anzahl von Würmern eine schwere Erkrankung verursachen. Infizierte Frettchen können sich mit einer akut einsetzenden, schwerfälligen Atmung präsentieren, die mit Anorexie, Lethargie und Zyanose einhergehen kann. Plötzlicher Tod kann auftreten, und das Vorhandensein einer erwachsenen Wurminfektion ist für Frettchen genauso lebensbedrohlich wie bei Hunden und Katzen.
Die Diagnose einer patenten Herzwurminfektion kann durch den Nachweis im Blut mittels direkter Abstriche oder des modifizierten Knott-Tests (ein empfindlicherer Test, da er die Mikrofilarien durch Zentrifugation konzentriert, so dass sie bei der mikroskopischen Untersuchung besser zu sehen sind) erfolgen. Dieser Test ist jedoch beim Frettchen nur begrenzt anwendbar, da die Würmer nur wenige Mikrofilarien über einen kurzen Zeitraum produzieren. Nützlicher sind Tests, die für den Nachweis von Herzwurm-Antigenen bei Hunden und Katzen entwickelt wurden. Es hat sich gezeigt, dass diese Tests Infektionen bei Frettchen ab einem Alter von 4 Monaten nachweisen können, also mindestens einen Monat früher als bei Hunden oder Katzen. Abweichende Darstellungen der Gefäßfüllung, die durch das Vorhandensein der Würmer verursacht werden, können manchmal mit Hilfe der Angiographie sehr deutlich gesehen werden. Die Radiographie kann bei Frettchen auch ein nützlicher diagnostischer Test für Kardiomegalie, Pleuraerguss und Aszites sein. Die Echokardiographie ist sogar noch nützlicher, da sie das dilatierte Herz mit dem darin befindlichen Wurm zeigen würde, der sich typischerweise als zwei parallel verlaufende echogene Linien darstellt.
Bandwurmbefall (Taenia spp., Mesocestoides spp., Dipylidium caninum) wird sporadisch bei Frettchen in menschlicher Obhut festgestellt. Sie infizieren sich durch Verzehr von Rohfleisch oder können in Freigehegen geeignete Zwischenwirte fangen und verzehren (Taenia oder Mesocestoides spp.), bzw. durch Aufnahme von Flöhen bei entsprechendem Befall (Dipylidium caninum). Der Bandwurmbefall bleibt asymptomatisch; er wird durch Auffinden von Proglottiden im Kot oder mikroskopischen Nachweis von Bandwurmeiern diagnostiziert.
Frettchen sind Endwirte für eine Isospora-Art und mehrere Eimeria-Arten, wovon E. furonis die pathogenste Art ist. Bei einzeln gehaltenen Tieren sind die Kokzidien nur sporadisch anzutreffen und haben keine klinische Bedeutung. In Gruppenhaltung und vor allem in Frettchenzuchten kann bei Jungtieren aber ein hochgradiger Befall auftreten und dann schwere Enteritiden verursachen. Frettchen infizieren sich durch orale Aufnahme der umweltresistenten Oozysten, die zuvor von infizierten Tieren mit dem Kot ausgeschieden wurden und in der Außenwelt binnen weniger Tage Ansteckungsreife erreichten. Die Diagnose erfolgt durch mikroskopischen Nachweis der Oozysten im Kot.
Eimeria-Arten der Frettchen sind wirtsspezifisch; sie können also nur diese, nicht aber andere Tierarten infizieren und haben auch keine zoonotische Bedeutung.
Giardien sind die am häufigsten nachgewiesenen Endoparasiten bei Frettchen. Die Trophozoiten leben auf der Dünndarmschleimhaut. Mit dem Kot ausgeschiedenen Zysten sind für wenige Wochen infektionsfähig und werden oral aufgenommen. Der Einzeller soll bei Jungtieren Durchfall auslösen, doch besteht i. d. R. ein asymptomatischer Befall. Die Diagnose erfolgt durch Nachweis von Giardia-Koproantigen oder mittels spezieller Technik (sog. SAF-Konzentrationsverfahren) mikroskopisch von Zysten im Kot.
Die zoonotische Bedeutung der bei Frettchen vorkommenden Giardia-Genotypen ist bislang unklar.
EKTOPARASITEN
Hunde- und Katzenflöhe (Ctenocephalides spp.) sind bei Frettchen häufig anzutreffende Parasiten. Frettchen, die zur Jagd auf Wildkaninchen verwendet werden, können auch vom Kaninchenfloh Spilopsyllus cuniculi befallen sein. Flohbefall verursacht Juckreiz und kann eine Flohspeichelallergie mit ausgeprägten Hautreaktionen verursachen. In Ausnahmefällen kann bei sehr starkem Befall auch Anämie entstehen. Es handelt sich zudem um eine Zoonose, die bei manchen Menschen starke Reaktionen auf die Flohstiche hervorruft.
Nach anekdotischen Berichten soll bei Frettchen ein Befall mit Hundehaarlingen (Trichodectes canis) möglich sein, wahrscheinlich aufgrund gemeinsamer Haltung mit Hunden.
Grabmilbenbefall (Sarcoptes scabiei) kann auch bei Frettchen in Hobbyhaltung vorkommen, insbesondere, wenn die Tiere zur Jagd verwendet werden. Die Adultstadien der Milben sind ca. 300–400 μm groß und leben in der oberflächlichen Epidermis. Die Übertragung erfolgt leicht durch direkten Kontakt von Tier zu Tier, aber auch indirekt beispielsweise durch kontaminierte Pflegeutensilien. Die Sarcoptes-Räude ist im Wesentlichen ein immunpathologisches Geschehen. Wie bei Hund oder Fuchs verursachen auch bei Frettchen bereits wenige Milben hochgradige Symptome mit starkem Juckreiz, Hautverletzungen durch Kratzen, Alopezie sowie Hyper- und Parakeratose mit borkig-krustöser Dermatitis. Die klinische Verdachtsdiagnose wird durch mikroskopischen Milbennachweis im Hautgeschabsel (KOH-Methode) bestätigt.
Sarcoptes ist wie andere Grabmilbenarten auf Menschen übertragbar und verursacht dann eine juckende Krätze-ähnliche Hauterkrankung. Bei Frettchen tritt auch gelegentlich ein Befall mit Otodectes cynotis (Abb. 26) auf, vor allem bei gemeinsamer Haltung mit Hunden oder Katzen. Die ca. 500 μm großen Ohrmilben verursachen eine Entzündung des äußeren Gehörgangs mit schmierigen oder trockenen Belägen. Lokaler Juckreiz mit Kratzen und Kopfschütteln der Tiere lässt einen Befall vermuten; die Diagnose wird durch Milbennachweis im Ohrgeschabsel bestätigt. Über vereinzeltes Vorkommen von O. cynotis bei Menschen wurde sporadisch berichtet. Die Tropische Rattenmilbe (Ornithonyssus bacoti) kommt originär bei Nagetieren vor (siehe Kapitel 2.a.), kann aber auch andere Säugetiere einschließlich Frettchen befallen. Diese blutsaugenden, Juckreiz auslösenden Milben sind auf der Haut der Wirtstiere und in Käfigeinrichtungen sowie der Einstreu zu finden (siehe Abb. 13).
Ornithonyssus bacoti ist ein Zoonose-Erreger und verursacht beim Menschen eine juckende Dermatitis.
Demodex-Milben kommen bei Frettchen vor. In seltenen Fällen verursachten sie eine erythrematös-exudative, schuppige Dermatitis mit Alopezie, wobei stets eine Immunsuppression (z. B. bei Morbus Cushing, Neoplasien oder nach Kortikosteroid-Behandlung) vorlag. Im klinischen Fall sind neben den zigarrenförmigen adulten Milben (Abb. 27) viele Jugendstadien und Eier im Hautgeschabsel nachweisbar.
Eine Übertragung auf Menschen ist nicht möglich.
Abb. 26: Otodectes cynotis (Weibchen mit Eiern)
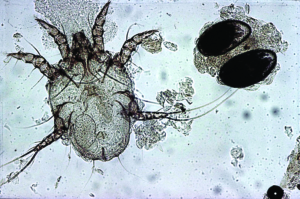
Abb. 27: Demodex spp.-Milben
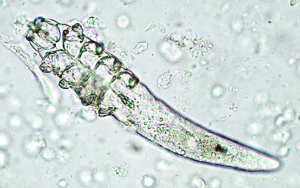
Abb. 28: Schildzeckenbefall bei einem Frettchen
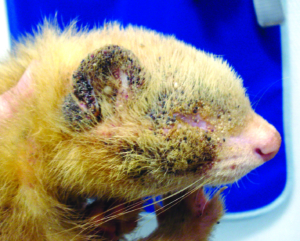
Ein Befall mit dem Gemeinen Holzbock (Ixodes ricinus) oder anderen Schildzeckenarten tritt bei Frettchen häufig auf (Abb. 28), vor allem, wenn sie zur Jagd benutzt werden.
HAUTMYKOSEN
Ring- oder Glatzflechte wird bei Frettchen (Abb. 29) durch Hautpilze des Trichophyton mentagrophytes-Komplexes oder durch Microsporum canis verursacht. Die Pilzsporen sind in der Außenwelt sehr resistent. Die Ansteckung erfolgt durch direkten Tierkontakt, über sporenkontaminierte Einstreu und sehr leicht auch bei der Pflege mit kontaminierten Utensilien. Jungtiere sind besonders anfällig und zeigen eher klinische Symptome als ältere Tiere. Diese beginnen mit Haarbruch, später sind kreisförmige oder diffuse Alopezie-Areale am Kopf typisch; in schweren Fällen kann der gesamte Körper betroffen sein. Juckreiz fehlt. Die klinische Verdachtsdiagnose lässt sich durch mikroskopischen Nachweis der Pilzsporen im Hautgeschabsel (KOH-Methode) oder durch Pilzkultur bestätigen (siehe Abb. 22).
Hautpilze sind zoonotisch bedeutsam; ihre Übertragung erfolgt vorwiegend durch Körperkontakt mit betroffenen Tieren. Sie verursachen beim Menschen ein ähnliches Krankheitsbild wie bei Tieren.
Abb. 29: Glatzflechte bei einem Frettchen
Zur Behandlung von Parasiten- und Pilzinfektionen bei Frettchen stehen nur sehr wenige zugelassene Medikamente zur Verfügung, so dass Präparate i. d. R. umgewidmet werden müssen („Off-Label-Anwendung“).
Bei Frettchen kann einem Befall mit Spulwürmern oder anderen Darmnematoden mit Präparaten aus der Hunde- und Katzenmedizin therapeutisch begegnet werden. Beispielsweise kann Moxidectin (1 mg/kg Körpergewicht Spot-on), Fenbendazol (50 mg/kg Körpergewicht/Tag oral an 3–5 aufeinanderfolgenden Tagen), Selamectin (15 mg/Tier Spot-on, auch in Monatsintervall) oder Ivermectin (2 x 0,4 mg/kg Körpergewicht subkutan im Abstand von 14 Tagen) eingesetzt werden (jeweils Umwidmung).
Wie bei Hunden ist die Behandlung einer Herzwurminfektion bei Frettchen komplex. Unter tierärztlicher Aufsicht können die gleichen Medikamente, die zur Behandlung von Herzwurmerkrankungen bei Hunden verwendet werden, für Frettchen angepasst werden. Die Vorbeugung und Behandlung von Mikrofilarien mit Imidacloprid und Moxidectin (0,1 ml der Spot-on-Lösung für kleine Katzen/Kätzchen topisch) ist in einigen Ländern für Frettchen zugelassen. Andere Behandlungsprotokolle umfassen die Verwendung von Ivermectin (0,05–0,1 mg/kg subkutan in monatlichen Abständen, bis die klinischen Symptome abgeklungen sind und keine Mikrofilarämie mehr vorliegt) oder die Verwendung von Adultiziden wie Melarsomin (2,5 mg/kg intramuskulär, gefolgt von zwei Injektionen im Abstand von einem Tag einen Monat später) und Thiacetarsemid (0,22 ml/kg intravenös zweimal täglich über zwei Tage). Die Behandlung des Herzwurms umfasst darüber hinaus eine symptomatische Behandlung, um die klinischen Anzeichen zu lindern, die aus der rechtsseitigen Herzinsuffizienz resultieren.
Praziquantel ist auch bei Frettchen das Mittel der Wahl zur Behandlung eines Bandwurmbefalls. Es wird in der Einmaldosis von 5–10 mg/kg Körpergewicht zweimal im Abstand von je 10–14 Tagen subkutan verabreicht (Umwidmung).
Kokzidienbefall bei Frettchen kann versuchsweise mit Amprolium (2 x 25 mg/kg Körpergewicht/Tag oral an 5–7 aufeinanderfolgenden Tagen) oder Sulfadimethoxin (Initialdosis 50 mg/kg Körpergewicht oral, dann 25 mg/kg Körpergewicht/Tag für 5–21 Tage) behandelt werden (jeweils Umwidmung).
Wie bei Kokzidiosen anderer Wirtstiere sollte die Behandlung durch Reinigungs- und Desinfektionsmaßnahmen in den Käfigen begleitet werden, um das Risiko erneuter Ansteckung zu minimieren.
Eine Giardiose bei Frettchen kann versuchsweise mit Fenbendazol 10–20 mg/kg Körpergewicht oral an 5 Tagen) oder Metronidazol (2 x 15–20 mg/kg Körpergewicht/Tag oral an 14 Tage; Umwidmung) behandelt werden. Bei Jungtieren mit hochgradigem Durchfall kann zusätzlich eine Rehydration erforderlich sein.
Flohbefall bei Frettchen ist durch Imidacloprid (40 mg/Tier Spot-on; zugelassen in fixer Kombination mit Moxidectin) im dreiwöchigen Abstand zu beseitigen. Weiterhin stehen zugelassene Kombinationspräparate mit Fipronil und dem Insekten-Entwicklungshemmer S-Methopren (50 mg Fipronil und 60 mg S-Methopren/Tier Spot-on) zur Verfügung. Zusätzlich ist es sinnvoll, die Umgebung der Tiere mit einem Biozid (Insekten-Entwicklungshemmer) zu behandeln, um den Lebenszyklus der Flöhe dauerhaft zu unterbrechen.
Bei Haarlingsbefall von Frettchen ist anzunehmen, dass der zugelassene Wirkstoff Fipronil (50 mg/Tier Spot-on) wirksam ist. Bei Therapieversagen kann der Einsatz von Selamectin (15 mg/kg Körpergewicht Spot-on; Umwidmung) oder auch der zweimalige Einsatz von Ivermectin (0,2–0,4 mg/kg Körpergewicht subkutan) oder Doramectin (0,5 mg/kg Körpergewicht subkutan) jeweils im Wochenabstand erfolgen (jeweils Umwidmung).
Zur Behandlung einer Sarcoptes-bedingten Körperräude eignet sich beim Frettchen beispielsweise die zweimalige Applikation von Ivermectin (0,2–0,5 mg/kg Körpergewicht subkutan) oder Doramectin (0,5 mg/kg Körpergewicht subkutan) in jeweils Wochenabstand. Auch der Einsatz von Selamectin
(2–3 x 15 mg/kg Körpergewicht Spot-on im Abstand von jeweils 14–30 Tagen) oder Ganzkörperbehandlung mit Fipronil-Spray (2 x im Abstand von 7–10 Tagen) wird empfohlen (jeweils Umwidmung).
Bei Ohrmilbenbefall sollten die äußeren Gehörgänge zuerst mit einem milden Antiseptikum gereinigt werden. Dann kann Selamectin (15 mg/Tier Spot-on in den Nackenbereich) verabreicht werden. Alternativ kann man je 1–2 Tropfen Fipronil-Lösung direkt in die Gehörgänge geben oder die Tiere mit Ivermectin (2 x 0,2–0,4 mg/kg Körpergewicht subkutan im Abstand von 14 Tagen) oder mit Moxidectin (2–3 x 2–5 mg/kg Körpergewicht Spot-on jeweils im 14-tägigem Abstand) medikieren (jeweils Umwidmung).
Zur Behandlung einer klinisch verlaufenden Demodikose beim Frettchen wird empfohlen, das Frettchen mit Ivermectin (0,4 mg/kg Körpergewicht subkutan; Umwidmung) in wöchentlichen Abständen so lange zu behandeln, bis Hautgeschabsel mindestens für einen Monat einen parasitologisch negativen Befund ergeben.
Angeheftete Zecken können mittels Zeckenzange entfernt werden. Einem Zeckenbefall ist durch monatliche Applikation des zugelassenen Wirkstoffs Fipronil (50 mg/Tier Spot-on; erhältlich in fixer Kombination mit Methopren) vorzubeugen. Bei unzureichendem Behandlungsergebnis kann alternativ Permethrin (1–2 Tropfen der Spot-on-Lösung für Tiere unter 400 g oder 3 Tropfen für schwerere Tiere) im Monatsintervall appliziert werden (Umwidmung).
HAUTMYKOSEN
Auch bei Frettchen besteht die Behandlung von Hautmykosen üblicherweise aus der Kombination von systemischer und topischer Behandlung. Eine systemische Behandlung erfolgt mit Itraconazol (2,5–10 mg/kg Körpergewicht oral; Umwidmung). Zur topischen Therapie stehen Enilconazol- und/oder Miconazol-haltige Präparate zur Verfügung (jeweils Umwidmung). Ob die eine oder die andere Substanz verwendet wird, hängt von der Bereitschaft der Tierhalterin/des Tierhalters ab, die Tiere entsprechend den Anwendungsempfehlungen zu baden oder zu shampoonieren. In jedem Fall sollte die topische Behandlung mindestens zweimal pro Woche erfolgen. Dabei sind die Tiere vor Unterkühlung zu schützen und sorgfältig nach der Behandlung gründlich abzutrocknen. Miconazol-Suspensionen können täglich bei kleineren Hautveränderungen verwendet werden. In einer Gruppe sollten alle Tiere unabhängig vom klinischen Bild behandelt werden.
Die Dauer der antimykotischen Behandlung richtet sich nach den Ergebnissen der Pilzkulturen: Die Therapie sollte erst nach zwei negativen Kulturen abgebrochen werden. Da die Pilzsporen sehr widerstandsfähig und langlebig sind, ist eine gründliche Desinfektion von Käfig, Häuschen, Pflegeutensilien etc. notwendig. Dafür kann es in größeren Tiergruppen hilfreich sein, zusätzlich zur individuellen Behandlung das Gehege zweimal wöchentlich für einige Monate mit einer Enilconazol-Lösung (50 mg/m2) zu besprühen, um das Risiko von Reinfektionen zu verringern.
TierhalterInnen sollten bei der Behandlung Einweghandschuhe und Schutzkleidung benutzen sowie danach Kleidung und Schuhe gründlich waschen und desinfizieren.
Dem Auftreten von Parasiten- und Pilzinfektionen wird durch Haltungs- und Hygienemaßnahmen sowie, falls erforderlich, präventivem Arzneimitteleinsatz vorgebeugt.
Grundsätzlich sollten neue, in einen Frettchenbestand verbrachte Tiere zweifelhafter Herkunft oder mit unbekannter Anamnese stets für einige Zeit separat in Quarantäne gehalten werden, bevor sie Kontakt mit bereits vorhandenen Tieren bekommen. Einstreu und Futter sollten von guter Qualität sein. Wenn Kontakt mit Hund oder Katze besteht, kann es sinnvoll sein, diese mit einem Zestodizid und gegen Flohbefall zu medikieren. Herzwurmerkrankungen in endemischen Gebieten können durch die prophylaktische topische Verabreichung von Moxidectin (0,1 ml der Spot-on-Lösung für kleine Katzen/Kätzchen topisch), Selamectin (18 mg/kg Körpergewicht topisch), Ivermectin (0,05 mg/kg Körpergewicht oral oder subkutan) oder Milbemycinoxim (1,15-2,33 mg/kg Körpergewicht oral) in monatlichen Abständen verhindert werden.
Haftungsausschluss:
Die Angaben in dieser Empfehlung gründen sich auf die Erfahrung und das Wissen der AutorInnen und wurden mit größtmöglicher Sorgfalt auf ihre Richtigkeit überprüft. AutorInnen und HerausgeberInnen übernehmen jedoch keine Haftung für jedwede Folgen, die aus einer Fehlinterpretation der enthaltenen Informationen resultieren, und geben weiterhin keinerlei Garantie. ESCCAP weist ausdrücklich darauf hin, dass bei Umsetzung der Empfehlungen in jedem Fall nationale und lokale Gesetzgebungen zu berücksichtigen sind. Alle genannten Dosierungen und Indikationen entsprechen dem derzeitigen Wissensstand, dennoch sollten TierärztInnen die jeweiligen Hinweise der Hersteller in Packungsbeilagen und Fachinformationen genau beachten.
DANKSAGUNG ABBILDUNGEN
ESCCAP bedankt sich bei folgenden Institutionen und Personen für die freundliche Genehmigung zur Reproduktion von Abbildungen:
• Christophe Bulliot (DVM, Nandy, Frankreich)
• Cristina Almeida (DVM, Algés, Portugal)
• Department für Infektionskrankheiten und Immunologie, Fakultät für Veterinärmedizin, Universität Utrecht
• Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich)
• John McGarry und Fakultät für Tiermedizin, Universität Liverpool
• Luís Madeira de Carvalho (Fakultät für Veterinärmedizin, Universität Lissabon)
• N. J. Schoemaker (Fakultät für Veterinärmedizin, Universität Utrecht)
• Y. R. A van Zeeland (Fakultät für Veterinärmedizin, Universität Utrecht)
BILDNACHWEIS
Titelbilder: Cristina Almeida (DVM, Algés, Portugal) & Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Kapitelbilder: Seite 6, 15, 22, 28, 32, 39, 45, 50 © 123rf.com; Abbildung 1 bis 28: Abb. 1: Ei von Passalurus ambiguus sowie Oozysten von Eimeria spp. und Abb. 2: Eimeria-Oozyste; von N. J. Schoemaker (Fakultät für Veterinärmedizin, Universität Utrecht); Abb. 3: Sporen des Hefepilzes Cyniclomyces guttulatus (Saccharomycopsis guttulata); von N. J. Schoemaker und Y. R. A van Zeeland (Fakultät für Veterinärmedizin, Universität Utrecht); Abb. 4: Cheyletiella parasitivorax und Abb. 5: Psoroptes-Räude bei einem Kaninchen; von Jacques Guillot, Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Abb. 6: Kopfschiefhaltung bei einem Kaninchen mit Verdacht auf eine Encephalitozoon cuniculi-Infektion; von Luís Madeira de Carvalho (Fakultät für Veterinärmedizin, Universität Lissabon); Abb. 7: Glatzflechte (Trichophytie) bei einem jungen Kaninchen; Abb. 8: Ei von Hymenolepis sp.; Abb. 9: Nosopsyllus fasciatus (Europäischer Rattenfloh); Abb. 10: Polyplax spinulosa; von Jacques Guillot, Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Abb. 11: Notoedres muris und Abb. 12: Notoedres muris-Befall bei einer Ratte; von N. J. Schoemaker und Y. R. A van Zeeland (Fakultät für Veterinärmedizin, Universität Utrecht); Abb. 13: Ornithonyssus bacoti; von Christophe Bulliot (DVM, Nandy, Frankreich); Abb. 14: Glatzflechte (Trichophytie) bei einer Ratte; Abb. 15: Myobia musculi; Abb. 16: Myocoptes musculinus; Abb. 17: Meerschweinchen mit weißen Nissen im Haarkleid; Abb. 18: Gliricola porcelli; Abb. 19: Chirodiscoides caviae; von Jacques Guillot, Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Abb. 20: Trixacarus caviae; vom Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Abb. 21: Durch Trixacarus caviae verursachte Hautschäden; von N. J. Schoemaker und Y. R. A van Zeeland (Fakultät für Veterinärmedizin, Universität Utrecht); Abb. 22: Mikroskopisches Bild von Pilzen des Trichophyton mentagrophytes-Komplexes; Abb. 23: Glatzflechte (Trichophytie) bei einem Meerschweinchen; Abb. 24: Demodex criceti; Abb. 25: Glatzflechte (Trichophyton mentagrophytes-Komplex) bei einem Chinchilla; Abb. 26: Otodectes cynotis (Weibchen mit Eiern); von Jacques Guillot, Department für Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich); Abb. 27: Demodex spp.-Milben; vom Department für Infektionskrankheiten und Immunologie, Fakultät für Veterinärmedizin, Universität Utrecht; Abb. 28: Schildzeckenbefall bei einem Frettchen und Abb. 29: Glatzflechte bei einem Frettchen; von Jacques Guillot, Department Parasitologie, École nationale vétérinaire d‘Alfort (EnvA, Maisons-Alfort, Frankreich)
Im Juli 2017 veröffentlichte der europäische Verband von Veterinärparasitologen ESCCAP die erste Empfehlung für die Bekämpfung von Erkrankungen der wichtigsten Parasiten und Pilzinfektionen bei Heimtieren in Europa: ESCCAP Guideline 07 Control of Parasites and Fungal Infections in Small Pet Mammals. Diesen Leitfaden bietet ESCCAP Deutschland e.V. ab nun auch zum Herunterladen im Tierärztebereich auf esccap.de an.
Die Empfehlung umfasst die häufigsten Heimtiere, denen TierärztInnen und Tiermedizinische Fachangestellte im Praxisalltag begegnen: Kaninchen, Ratten, Mäuse, Wüstenrennmäuse, Meerschweinchen, Hamster, Chinchillas und Frettchen. Zu jedem Heimtier geht die Empfehlung auf die wichtigsten parasitären Erkrankungen sowie Pilzerkrankungen ein als auch das Zoonoserisiko.
VeterinärmedizinerInnen erhalten hier praxisorientierte Informationen an die Hand und Angaben zu einzelnen Parasiten, deren Behandlung sowie den entsprechenden Präventionsmöglichkeiten geliefert. Da es nur wenige zugelassene Behandlungen für Parasiten- und Pilzinfektionen bei Heimtieren gibt, finden sich in der Empfehlung off-label Verwendungen. Während in einigen europäischen Ländern Ausnahmen für die Verwendung nicht lizenzierter Produkte gewährt werden, trifft dies für einige Länder nicht zu. Entsprechend ist es eine tierärztliche Entscheidung, welche Medikamente zu verwenden sind.
Die ESCCAP-Empfehlung 7 Control of Parasites and Fungal Infections in Small Pet Mammals ist aktuell nur in englischer Sprache verfügbar. Die Behandlungsempfehlungen sind in dieser Version noch nicht länderspezifisch adaptiert. Eine Version in deutscher Sprache mit entsprechenden Anpassungen an die in Deutschland geltenden länderspezifischen Behandlungsempfehlungen durch ESCCAP Deutschland e.V. ist in Planung. Um TierärztInnen jedoch den Zugang zu den europäischen Therapieempfehlungen zu erleichtern, wird die europäische Version bereits in dieser Form angeboten.
Im Juli 2017 veröffentlichte der europäische Verband von Veterinärparasitologen ESCCAP die erste Empfehlung für die Bekämpfung von Erkrankungen der wichtigsten Parasiten und Pilzinfektionen bei Heimtieren in Europa: ESCCAP Guideline 07 Control of Parasites and Fungal Infections in Small Pet Mammals. Diesen Leitfaden bietet ESCCAP Deutschland e.V. ab nun auch zum Herunterladen im Tierärztebereich auf esccap.de an.
Die Empfehlung umfasst die häufigsten Heimtiere, denen TierärztInnen und Tiermedizinische Fachangestellte im Praxisalltag begegnen: Kaninchen, Ratten, Mäuse, Wüstenrennmäuse, Meerschweinchen, Hamster, Chinchillas und Frettchen. Zu jedem Heimtier geht die Empfehlung auf die wichtigsten parasitären Erkrankungen sowie Pilzerkrankungen und das Zoonoserisiko ein.
VeterinärmedizinerInnen erhalten hier praxisorientierte Informationen und Angaben zu einzelnen Parasiten, deren Behandlung sowie den entsprechenden Präventionsmöglichkeiten. Da es nur wenige zugelassene Behandlungen für Parasiten- und Pilzinfektionen bei Heimtieren gibt, finden sich in der Empfehlung off-label Verwendungen. Während in einigen europäischen Ländern Ausnahmen für die Verwendung nicht lizenzierter Produkte gewährt werden, trifft dies für einige Länder nicht zu. Entsprechend ist es eine tierärztliche Entscheidung, welche Medikamente zu verwenden sind.
Die ESCCAP-Empfehlung 7 Control of Parasites and Fungal Infections in Small Pet Mammals ist aktuell nur in englischer Sprache verfügbar. Die Behandlungsempfehlungen sind in dieser Version noch nicht länderspezifisch adaptiert. Eine Version in deutscher Sprache mit entsprechenden Anpassungen an die in Deutschland geltenden länderspezifischen Behandlungsempfehlungen durch ESCCAP Deutschland e.V. ist in Planung. Um TierärztInnen jedoch den Zugang zu den europäischen Therapieempfehlungen zu erleichtern, wird die europäische Version bereits in dieser Form angeboten.
© ESCCAP Deutschland
