Unsere Partner
© ESCCAP Deutschland
Einleitung
Biologie, Symptomatik, Diagnose und Bekämpfung von Ektoparasiten
1. Flöhe
2. Zecken
3. Läuse und Haarlinge
4. Sandmücken
5. Stechmücken
6. Demodikose
7. Sarcoptes-Räude
8. Notoredes-Räude
9. Otodectes-Räude
10. Pelzmilbenbefall (Cheyletiellose)
11. Befall mit Beotrombicula autumnalis (Grasmilbenbefall/Trombiculose)
12. Nasenmilbenbefall des Hundes
Individuelle Faktoren: Haltung, Lebensumfeld, Alter, Erkrankungen
Resistenz
Bekämpfung von Ektoparasiten in der Umgebung
Prävention von Zoonosen
Schulung von Praxisteam, TierhalterInnen und Öffentlichkeit
Zu den externen Parasiten oder Ektoparasiten gehört eine Vielzahl parasitischer Arthropoden, die taxonomisch der Unterklasse Acari (Zecken und Milben) und der Klasse Insecta (Flöhe, Läuse, Haarlinge, Stechmücken, Fliegen und Sandmücken [Phlebotomen]) zugeordnet werden (Tabelle 1). Ektoparasiten sind aus folgenden Gründen für die veterinärmedizinische Praxis relevant:
Die meisten für Hunde und Katzen zugelassenen Ektoparasitika verfügen über eine schnell einsetzende und über mehrere Wochen anhaltende Wirkung und lassen sich damit sowohl therapeutisch bei vorliegendem Befall als auch prophylaktisch zur Verhinderung eines (erneuten) Befalls verwenden. Wie alle Tierarzneimittel müssen auch Ektoparasitika ein strenges Zulassungsverfahren durchlaufen, für jede in der Fachinformation genannte Indikation ist ein wissenschaftlicher Nachweis erforderlich.
Da viele Ektoparasiten als Überträger verschiedener wichtiger Haustierkrankheiten fungieren können, ist es das Ziel der ESCCAP, einen Leitfaden zu erstellen, der umfassende Informationen und Unterstützung bietet, um sowohl TierärztInnen als auch HaustierbesitzerInnen bei der erfolgreichen Kontrolle von Ektoparasiteninfektionen und der Verhinderung der Krankheitsübertragung auf ihre Haustiere zu unterstützen. Diese Leitlinie konzentriert sich auf die wichtigsten Gruppen von Ektoparasiten, nämlich Zecken, Milben, Flöhe und Läuse (die taxonomisch aus zwei verschiedenen Gruppen bestehen, den Läusen und den Haarlingen). Andere Ektoparasiten wie Phlebotome (Sandmücken) und Stechmücken sind hauptsächlich als Krankheitsüberträger von Bedeutung und werden, obwohl hier nur kurz erwähnt, in einer separaten Richtlinie der ESCCAP über vektorübertragene Krankheiten von Haustieren (ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen) genauer behandelt.
Der zunehmende Reiseverkehr mit Tieren und die klimatischen Veränderungen werden vermutlich das Vorkommen bestimmter Ektoparasiten ausweiten. Ebenso werden sich die Erreger, die einige Ektoparasitenarten beherbergen, möglicherweise in andere Regionen verbreiten. So breitete sich beispielsweise die canine Babesiose von den ursprünglichen endemischen Gebieten im Mittelmeerraum und osteuropäischen Ländern in den vergangenen Jahren bis nach Zentralund Nordeuropa aus.
Darüber hinaus hat innerhalb der Europäischen Union die Abschaffung der Grenzkontrollen im Rahmen des Schengener Abkommens zu einem einfachen Reiseverkehr zwischen den verschiedenen Ländern Kontinentaleuropas geführt. Leider trägt dies auch zu nicht genehmigten und sogar illegalen Transporten von Heimtieren innerhalb Europas bei. Mit Ausnahme des Vereinigten Königreichs gibt es keine oder nur begrenzte Zollkontrollen bei der Beförderung von Heimtieren von einem Land in ein anderes. Während Haustiere, die mit ihren BesitzerInnen reisen, einen großen Teil der Gesamttransporte von Haustieren ausmacht, wird eine große Anzahl von Hunden und in geringerem Maße auch von Katzen von Tierschutzorganisationen z. B. aus den Mittelmeerländern in Privathaushalte in ganz Europa umgesiedelt. Dies ist besonders bedeutsam, da der Mittelmeerraum ein Gebiet ist, in dem der Befall mit zahlreichen Ektoparasiten oder von diesen übertragenen Krankheitserregern stark verbreitet ist.
Tierarzneimittel müssen vor ihrer Zulassung durch europäische oder nationale Behörden ein strenges Testverfahren durchlaufen, und jede Anwendungsindikation muss wissenschaftlich begründet werden. TierärztInnen werden in der sachgemäßen Verwendung dieser Verbindungen gemäß der geltenden nationalen Gesetzgebung ausgebildet.
Ektoparasitizide Präparate für Haustiere können prophylaktisch oder therapeutisch zur Bekämpfung von Ektoparasiten eingesetzt werden. Befall mit Flöhen, Läusen, Haarlingen, Milben oder Zecken erfordert eine Behandlung zur Beseitigung der Infestation. Die meisten Ektoparasitizide haben jedoch eine Restwirkung und können daher prophylaktisch eingesetzt werden, um einen erneuten Befall zu verhindern.
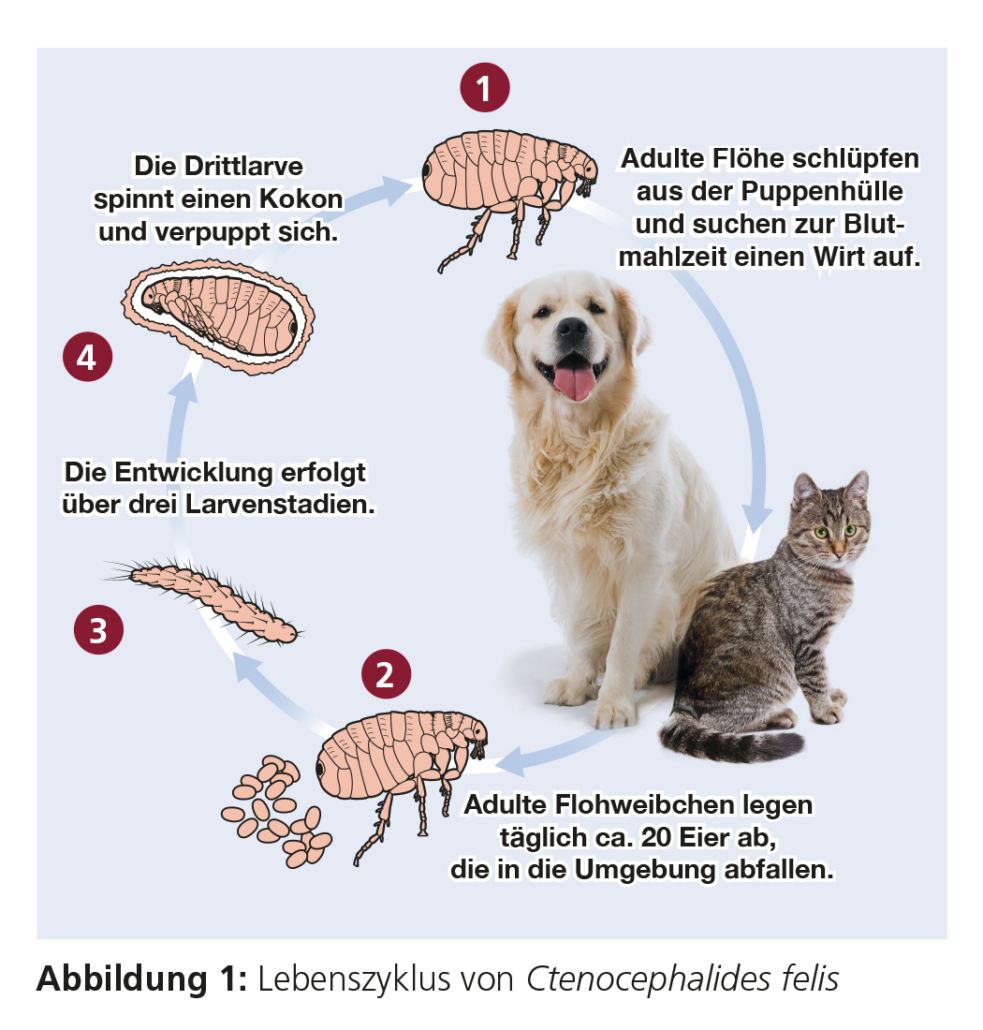
Flöhe (Siphonaptera) sind flügellose, seitlich abgeplattete, blutsaugende Insekten, die bei Säugetieren und Vögeln vorkommen. Die im Folgenden genannten Floharten sind in ganz Europa verbreitet. Auf dem Wirtstier finden sich nur die adulten Stadien. Eier, vor allem aber die Larven und Puppen befinden sich dagegen in der Umwelt und stellen den Großteil der Flohpopulation in dem betroffenen Haushalt dar. Ein Flohbefall tritt bei Katzen, Hunden und anderen kleinen Säugetieren relativ häufig auf.
Flohstiche können Juckreiz verursachen. Bei sensibilisierten Tieren ist dieser besonders stark ausgeprägt. Bei massiv befallenen Tieren kann es darüber hinaus zu einer Anämie kommen. Flöhe können außerdem als Vektoren für Krankheitserreger fungieren. Der Katzenfloh Ctenocephalides felis ist unter anderem Vektor für Rickettsia felis und Bartonella henselae, die Erreger der Katzenkratzkrankheit.
C. felis und der Hundefloh C. canis dienen ferner als Zwischenwirt für den Bandwurm Dipylidium caninum. (Mehr Informationen finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen.)
Die im Folgenden genannten Floharten sind wenig wirtsspezifisch und können auch Menschen befallen, diese stechen und juckende Hautveränderungen hervorrufen.
Die häufigste Flohart bei Hunden, Katzen und als Heimtieren gehaltenen kleinen Säugern ist C. felis (Katzenfloh). Dies macht deutlich, dass die namentliche Bezeichnung des Flohs nicht gleichzusetzen ist mit der von ihm befallenen Tierart. Der Häufgkeit eines Befalls mit C. felis folgt die mit C. canis (Hundefloh) und Archaeopsylla erinacei (Igelfloh). Gelegentlich kommen Ceratophyllus gallinae, Echidnophaga gallinacea (Geflügelflöhe), Spilopsyllus cuniculi (Kaninchenfloh), Pulex irritans (Menschenfloh) und weitere Floharten vor.
Das Überleben und die Entwicklung der Flohstadien in der Umgebung hängen in hohem Maße von den Umgebungsbedingungen ab. Unter idealen Bedingungen läuft die Entwicklung vom Ei zum adulten Floh in 14 Tagen ab, bei ungünstigen Bedingungen kann sie bis zu 140 Tage dauern.
Die Entwicklung und das Überleben der nicht auf dem Wirt, sondern in der Umgebung befindlichen Stadien hängen von den Umgebungsbedingungen ab (Tabelle 2). Bei höheren Temperaturen läuft die Entwicklung schneller ab, so dass diese durch Jahreszeiten maßgeblich bestimmt wird. Förderlich wirkt sich ferner eine feuchte, aber nicht nasse Umgebung aus, die zudem keiner starken direkten Sonneneinstrahlung unterliegt. Für die Entwicklung in Innenräumen spielen die Jahreszeiten keine Rolle, da Zentralheizung und relative Luftfeuchtigkeit von mehr als 50 % das ganze Jahr über geeignete Bedingungen für die Entwicklung von Flöhen darstellen.
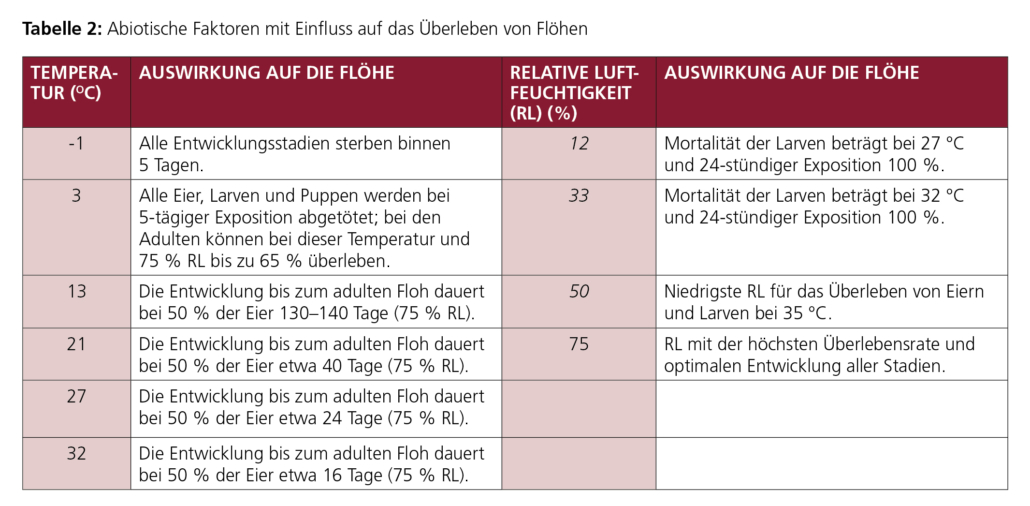
Nach Erreichen des Puppenstadiums bietet der Kokon einen guten Schutz gegenüber ungünstigen Umgebungsbedingungen. Dieser Schutz erstreckt sich sogar auf Insektizide, mit denen Räume oder Schlafstätten der Tiere behandelt werden. So kann der noch nicht ausgereifte Floh im Kokon trotz Umgebungsbehandlung mit einem Insektizid über mehrere Monate (≥ 6 Monate) überleben.
C. felis weist eine außerordentlich geringe Wirtsspezifität auf und kann nicht nur bei Katzen und Hunden, sondern auch bei vielen Heimtieren wie Kaninchen und Frettchen sowie bei wildlebenden Säugetieren gefunden werden, die dann wieder als Infektionsquelle dienen können. Grundsätzlich ist eine direkte Übertragung adulter Flöhe möglich, vor allem bei engem Kontakt der Tiere. Meist jedoch kommt es zur Kontamination der Umgebung mit Eiern, so dass eine Infestation durch neu entwickelte adulte Flöhe erfolgt. Auch C. canis ist wenig wirtsspezifisch. Ein Befall mit anderen Floharten weist in der Regel auf einen engen Kontakt von Hunden und Katzen zu anderen Tierarten oder deren Lebensraum hin. So lassen sich beispielsweise Igelflöhe (A. erinacei) gelegentlich auf Hunden oder Katzen nachweisen, nachdem diese Kontakt zu einem Igel oder dessen Bau hatten.
Ein Flohbefall bei Hunden und Katzen und anderen kleinen Säugetieren kann in der Stärke des Befalls stark variieren (wenige bis sehr viele Flöhe) und sich klinisch unterschiedlich äußern. Die Ausbildung von Krankheitserscheinungen bei einem Flohbefall hängt von folgenden Faktoren ab:
Nicht sensibilisierte Tiere können keine oder geringe Symptome aufweisen und kratzen sich nur gelegentlich. Tiere, die eine immunologische Reaktion auf den Flohspeichel entwickelt haben, zeigen Juckreiz, Alopezie, Haarbruch, Papeln und erythematöse Veränderungen mit Krusten. Eine nässende Dermatitis kann oft im Bereich des Rutenansatzes entstehen und die Veränderungen können sich auf die Hintergliedmaßen und den Bauch ausbreiten. Nicht selten resultiert daraus eine sekundäre pyotraumatische Dermatitis, Pyodermie und Seborrhoe. In chronischen Fällen findet sich eine verdickte Dermis mit Akanthose, Hyperkeratose und Lichenifikation.
Ein ausgeprägter, über längere Zeit bestehender Flohbefall bei jungen, alten oder geschwächten Tieren kann aufgrund des Blutverlustes eine Anämie verursachen. Eine Infektion mit dem Bandwurm Dipylidium caninum, für den Flöhe als Zwischenwirte dienen, ist ein deutlicher Hinweis auf eine bestehende oder kurz zurückliegende Flohinfestation.
Eine gründliche Anamnese kann bei der Diagnose eines Flohbefalls hilfreich sein. Bei stärkerem Befall lassen sich die Flöhe mit dem bloßen Auge feststellen, vor allem bei Tieren mit hellem Fell und blasser Haut. Die Flöhe sind als braune, seitlich abgeplattete, flügellose Insekten zu erkennen. Bei Tieren mit langem und dichtem Fell gestaltet sich die Adspektion schwieriger. Das Kämmen des Tieres mit einem engzackigen Flohkamm stellt die sensitivste Methode für den Nachweis eines Flohbefalls dar. Auch wenn keine adulten Flöhe auf dem Tier zu finden sind, lässt sich unter Umständen Flohkot auf dem Tier oder in dem ausgekämmten Material nachweisen. Das Material wird auf ein angefeuchtetes weißes Papier, Gaze o. ä. verbracht. Handelt es sich um Flohkot, entwickelt sich um das schwarze Material ein roter Ring aus unverdautem Blut.
Bei Tieren mit klinischen Anzeichen für eine Dermatitis durch allergische Reaktion auf den Flohspeichel (Flohspeichelallergiedermatitis, FAD) ist der Nachweis adulter Flöhe manchmal schwierig, da die Flöhe durch das intensive Putzverhalten eliminiert werden. Für die Praxis steht auch eine Reihe von Allergietests zur Verfügung, wobei keiner bisher als Goldstandard gilt. Diese Tests können im positiven Fall zur Diagnosefindung beitragen, schließen aber im negativen Fall die FAD nicht aus. Die Diagnose FAD ist dagegen gesichert, wenn Flöhe (oder Flohkot) auf dem Tier zu finden sind, die klinischen Symptome auf eine entsprechende Behandlung ansprechen und andere Ursachen ausgeschlossen werden können.
Eine sachgerechte Flohbekämpfung hat zum Ziel, einen Flohbefall bei Haustieren zu verhindern. Das individuelle Risiko einer Infestation oder Reinfestation hängt von der individuellen Lebensweise des Tieres ab.
Folgende Fragen können bei der Entwicklung geeigneter Maßnahmen hilfreich sein:
Ist die Wahrscheinlichkeit für eine Reinfestation hoch, empfiehlt sich eine regelmäßige, eventuell ganzjährige Prophylaxe durch Anwendung geeigneter Tierarzneimittel. Auch wenn der Flohbefall im Sommer und Herbst am häufigsten auftritt, haben Studien gezeigt, dass eine Infestation mit Flöhen in jeder Jahreszeit möglich ist.
Die erfolgreiche Bekämpfung von Flöhen ist auf eine gute Compliance der TierhalterInnen angewiesen. Ursachen für das Versagen eines sachgerecht entwickelten Behandlungsprotokolls können unter anderem sein:
1) Minimales Infestationsrisiko (z. B. Tiere mit begrenztem oder keinem Zugang ins Freie und ohne Kontakt zu anderen Tieren):
Tiere mit minimalem Infestationsrisiko sollten im Rahmen der Fellpflege regelmäßig auf einen Flohbefall inspiziert werden, vorzugsweise unter Verwendung eines Flohkamms. Wird dabei ein Flohbefall frühzeitig festgestellt, kann eine einmalige therapeutische Behandlung ausreichen, um diesen zu eliminieren.
2) Moderates Infestationsrisiko (z. B. Tiere mit regelmäßigem Zugang ins Freie und Kontakt zu anderen Tieren):
Zur Verhinderung eines Flohbefalls wird bei diesen Tieren die regelmäßige Anwendung eines geeigneten Ektoparasitizides empfohlen. Da sich die meisten Entwicklungsstadien der Flöhe dort befinden, wo Hunde und Katzen bevorzugt liegen, sollten diese „neuralgischen Stellen“ in der Umgebung zusätzlich regelmäßig gereinigt bzw. gewaschen oder mit einem Umgebungsmittel (Pestizid) behandelt werden.
3) Hohes, anhaltendes Risiko einer Reinfestation (z. B. Tierheime, Zuchten, Haushalte mit mehreren Tieren, Jagdhunde):
In größeren Tierbeständen, Tierheimen, bei Zwingerhaltung oder anderen Haltungs- und Nutzungsformen, die ein hohes, anhaltendes Risiko einer Reinfestation mit sich bringen, wird eine ganzjährige integrierte Flohbekämpfung empfohlen. Kombiniert werden die Anwendung geeigneter Insektizide am Tier in dafür vorgesehenen Intervallen mit täglichem Saugen oder mechanischer Reinigung von Boxen und Ruheplätzen.
Zur Bekämpfung der Eier, Larven und Puppen sollten zusätzlich geeignete Produkte in der Umgebung oder am Tier angewendet werden.
4) Tiere mit nachgewiesener allergischer Reaktion auf Flohspeichel (FAD):
Bei Tieren mit FAD muss die Exposition gegenüber Antigenen des Flohspeichels minimiert und idealerweise ausgeschlossen werden, um klinische Erscheinungen zukünftig zu verhindern. Demzufolge empfiehlt sich eine kontinuierliche Flohbekämpfung. Hierzu gehören die ganzjährige Anwendung von Insektiziden am Tier sowie geeignete Maßnahmen in der Umgebung. Lebt ein Tier mit FAD in einem Haushalt mit mehreren Tieren, sollten auch diese in die Maßnahmen einbezogen werden.
5) Flohbefall bei TierhalterInnen:
Menschen werden von Flöhen befallen, wenn aufgrund einer starken Infestation eine Vielzahl adulter Flöhe schlüpft und kein geeigneterer Wirt zur Verfügung steht. In diesem Fall wird eine Flohbekämpfung bei allen Tieren des Haushaltes sowie in der Umgebung empfohlen.
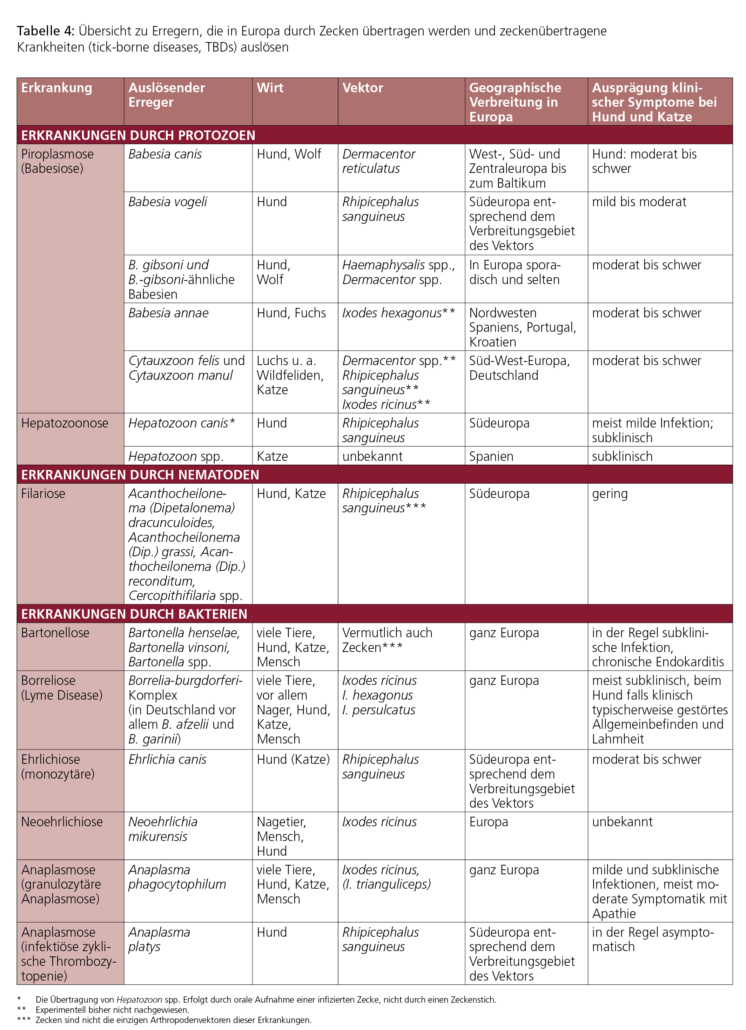
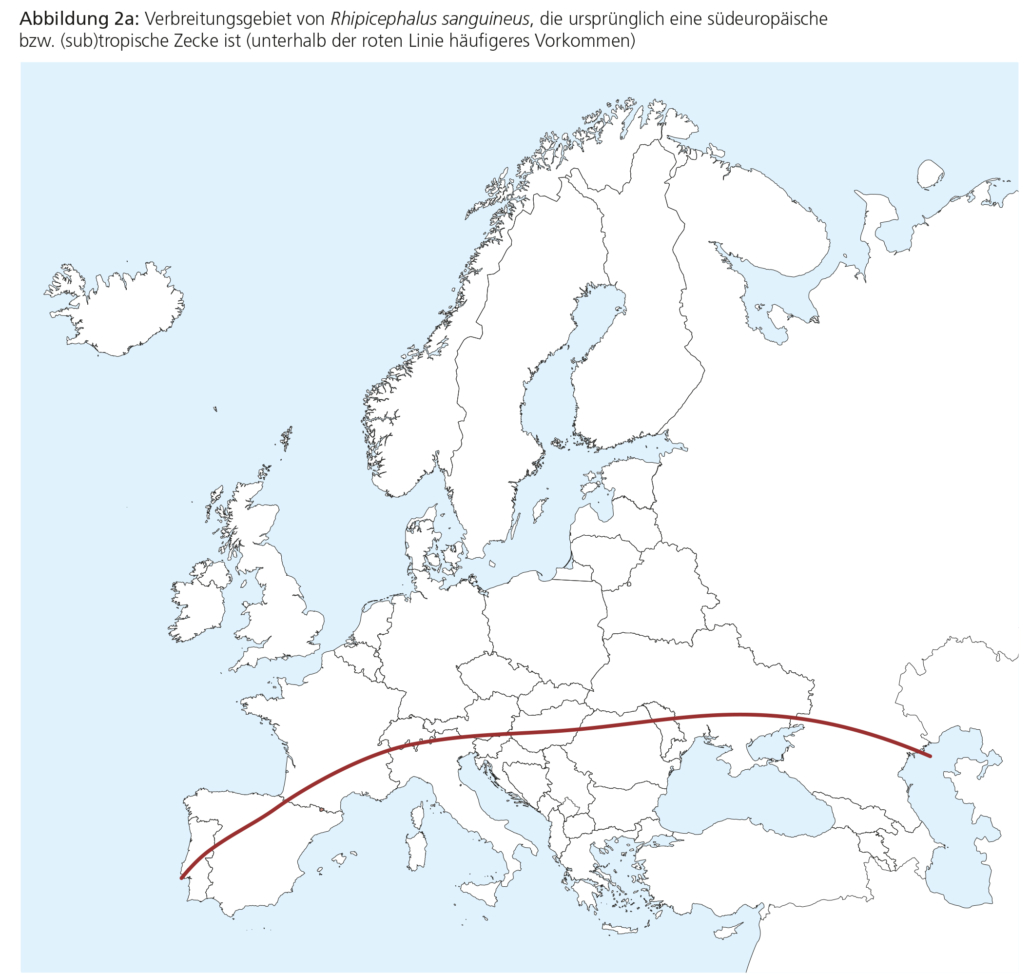
Bei Zecken werden zwei Familien unterschieden: Ixodidae (Schildzecken) und Argasidae (Lederzecken). Die in Europa auf Katzen und Hunden festgestellten Zecken sind ausschließlich Vertreter der Familie Ixodidae (Schildzecken). Zu ihnen gehören Arten der wichtigen Gattungen Ixodes, Dermacentor und Rhipicephalus, die sich hinsichtlich biologischer Eigenschaften und geografhischer Verbreitung unterscheiden (Tabelle 3). Weibliche Schildzecken saugen vor der Eiablage Blut, ihr Gewicht steigt dabei bis auf das 120-Fache an. Eine vollgesogene weibliche Ixodes-Zecke kann eine Größe von etwa 1 cm erreichen, vollgesogene Dermacentor-Zecken sind meist sogar größer. Ixodes-Zecken sind in ganz Europa verbreitet. Die Abbildungen 2a und b zeigen darüber hinaus die hauptsächlichen Verbreitungsgebiete von Rhipicephalus und Dermacentor.
Zecken sind Parasiten, die für einige Tage Blut saugen und sich unterschiedlich lange auf ihren Wirten aufhalten. Bei Schildzecken dauert der Saugakt je nach Entwicklungsstadium 2–14 Tage. Klinisch betrachtet sind Zecken vor allem als Vektoren für Protozoen, Bakterien und Viren von Bedeutung, die von der Zeckenart und dem geografischen Standort abhängt (Tabelle 4). Infektionen können während des Saugakts über den Speichel übertragen werden oder im Fall von Hepatozoon spp. nach oraler Aufnahme der Zecke durch den Wirt.
Zu den in Europa auf Katzen und Hunden festgestellten Schildzecken gehören Arten der Gattungen Ixodes, Dermacentor und Rhipicephalus sowie der weniger bedeutsamen Gattungen Haemaphysalis und Hyalomma (Tabelle 3). In Nordeuropa und Großbritannien handelt es sich bei Zecken, die Katzen und Hunde befallen, meist um Ixodes oder Dermacentor spp. Vertreter der Gattung Hyalomma sind derzeit nur in Südosteuropa heimisch, werden jedoch auch nach Deutschland durch z. B. Zugvögel eingetragen und können nach Entwicklung zum Adultstadium Haustiere befallen. Die meisten Zeckenarten können bei Hunden oder Katzen sowie
einer Reihe anderer Tierarten Blut saugen. Die beiden Arten Ixodes canisuga und Rhipicephalus sanguineus kommen meist bei Caniden vor.
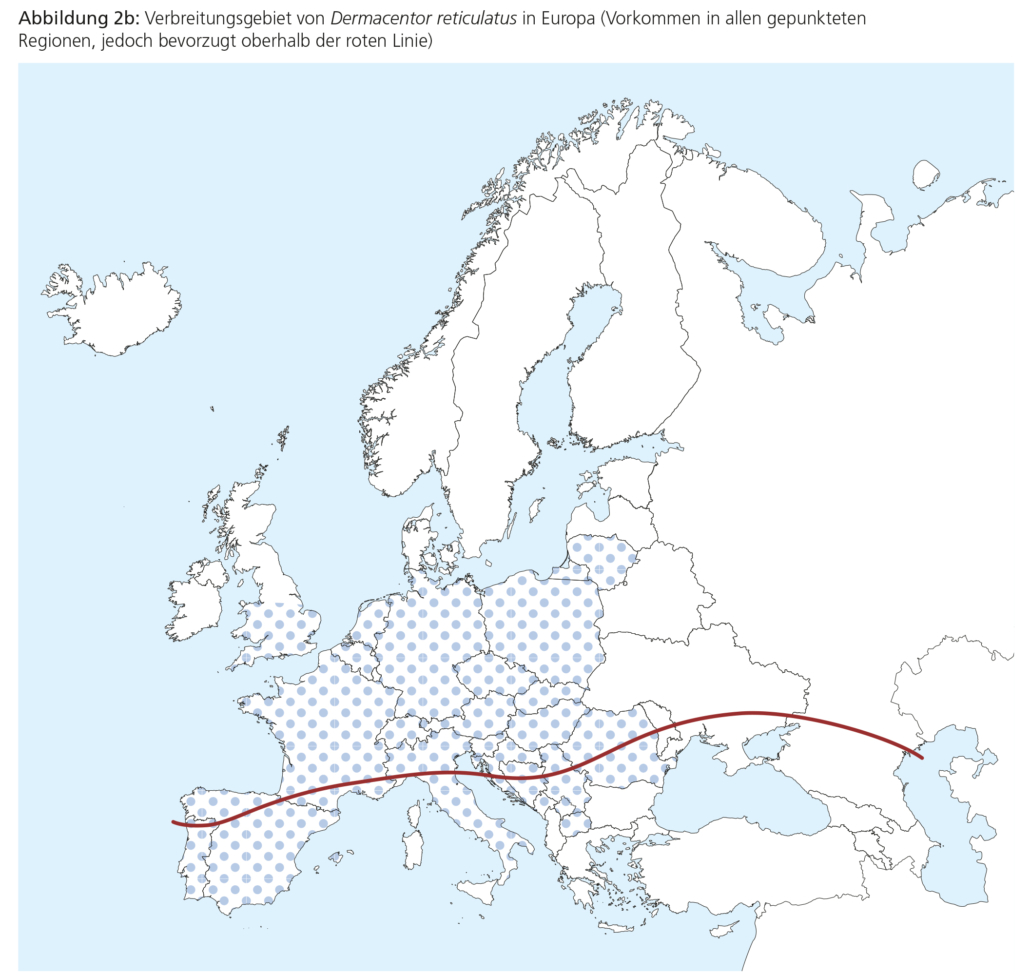
Abbildung 3 veranschaulicht den Lebenszyklus von Schildzecken am Beispiel von Ixodes ricinus. Die in Zentraleuropa heimischen Zeckenarten sind vorwiegend dreiwirtige Zecken, d. h. jedes Entwicklungsstadium sucht aktiv einen neuen Wirt zum Blutsaugen auf. Bei der Wirtssuche erklimmen Larven, Nymphen oder Adulte von I. ricinus die Blätter kleiner Pfl anzen oder Grashalme, von denen aus sie auf ihre Wirte überkrabbeln.
Das Vorkommen von Zecken sowie deren Dichte in einem Gebiet werden unter anderem vom Klima, Biotop und der Zahl vorhandener Wirte bestimmt. Veränderungen des (Mikro-) Klimas oder der Populationsdichte der Wirte sowie der Import von Zecken oder befallener Wirte aus anderen Regionen können das Vorkommen und die geographische Verbreitung verschiedener Zeckenarten beeinfl ussen. Auch Änderungen in Wildtierpopulationen können sich auf Vorkommen von Zecken auswirken.
Die Infestation mit autochtonen Zeckenarten hängt in hohem Maße von der Jahreszeit ab. So lassen sich für I. ricinus in Zentraleuropa typischerweise zwei Gipfel feststellen: von März bis Juni und von September bis November. Die Aktivität 2.1 Biologische Grundlagen beginnt bei D. reticulatus früher und endet später. In Südeuropa kann R. sanguineus über das ganze Jahr aktiv sein. In Nord- und Mitteleuropa überlebt R. sanguineus aufgrund der kühleren Witterung üblicherweise nicht im Freien, kann seinen Lebenszyklus jedoch innerhalb von Wohnhäusern, Tierheimen oder Hundezwingern vollenden. In Deutschland wie überhaupt in Zentraleuropa ist das saisonale Zeckenvorkommen von klimatischen Veränderungen abhängig. So wird im Zuge der Klimaerwärmung zunehmend auch eine Aktivität von Zecken in Deutschland während der Wintermonate festgestellt, so dass insbesondere in warmen Jahren mit einer ganzjährigen Zeckenaktivität gerechnet werden muss.
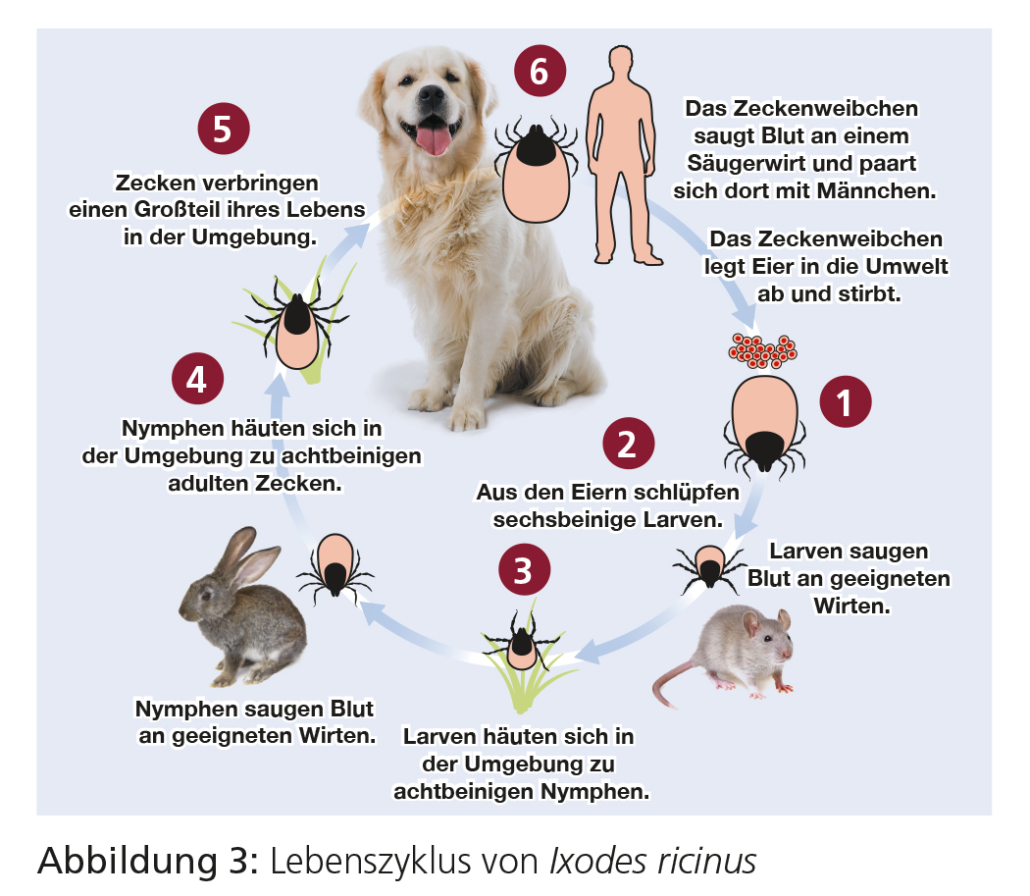
1 Zeckenweibchen legt Eier in der Umwelt ab und stirbt.
2 In der Umwelt schlüpfen aus den Eiern sechsbeinige Larven. Die Larven ernähren sich schnell (2–3 Tage) durch eine Blutmahlzeit von einem geeigneten Wirt.
3 Die Larven kehren in die Umwelt zurück, um sich zu einer achtbeinigen Nymphe zu häuten.
4 Achtbeinige Nymphen benötigen eine erneute Blutmahlzeit (4–6 Tage) von einem geeigneten Wirt. Die Nymphen kehren in die Umwelt zurück und häuten sich zu adulten Zecken. Die Nymphen verbringen die meiste Zeit in der Umwelt.
5 Adulte, achtbeinige Zecke; verbringt die Zeit bis zur Wirtsfi ndung in der Umwelt.
6 Die Weibchen ernähren sich während einer einzigen Blutmahlzeit von ca. 5–14 Tagen, meist von einem großen Säugetierwirt, z. B. Hund, Hausvieh oder Reh.
Zecken können überall am Körper des Wirtstieres gefunden werden. Prädilektionsstellen sind dünn behaarte Körperpartien mit dünner Haut an Kopf, Ohren, Achseln, Interdigitalspalt, Inguinal- und Perianalbereich. Bei schwerem Befall und unter bestimmten Umständen kann das Blutsaugen eine Anämie verursachen. Anhaftende, vollgesogene weibliche Zecken fallen besonders leicht auf. Eine durch einen Zeckenstich verursachte Wunde kann sich infi zieren. Wird eine Zecke nicht sachgerecht entfernt, entwickeln sich mitunter durch in der Haut verbliebene Mundwerkzeuge kleine entzündliche Reaktionen bzw. Granulome.
Klinische Bedeutung haben Zecken vor allem als Vektor pathogener Erreger zeckenübertragener Krankheiten (tick-borne diseases, TBDs). Die Übertragung fi ndet mit dem Stich und dem Saugakt statt, wobei es viele Stunden bis Tage dauern kann, ehe es nach dem Stich der Zecke zu einer Übertragung von Erregern kommt. Der Speichel stellt das Hauptmedium für die Erregerübertragung dar. Zu den von Zecken übertragenen Erregern gehören u. a. Babesia spp., Borrelia burgdorferi sensu latu, Acanthocheilonema (Dipetalonema) spp., Bartonellaspp., Ehrlichiaspp., Anaplasma phagocytophilum, A. platys, Rickettsia spp., Flaviviren und andere. Eine Zecke kann mehr als einen Erreger beherbergen, so dass sich unter Umständen klinische Veränderungen ergeben, die für das Vorliegen einer einzelnen Erkrankung untypisch sind. Klinische Erscheinungen können auftreten, solange ein Zeckenbefall noch offensichtlich ist oder aber deutlich später. Tabelle 4 bietet eine Übersicht zeckenübertragener Infektionen. Mehr Informationen finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen.
Eine Infestation wird üblicherweise durch Nachweis von Zecken auf dem Tier diagnostiziert. Dabei ist es deutlich schwieriger, kleine Larven- und Nymphenstadien zu sichten, als adulte, vollgesogene Zecken. Dort, wo es zweckmäßig erscheint, kann im Labor eine Identifizierung der jeweiligen Zeckenart erfolgen. Als Folge von Zeckenstichen kann es zu lokalen Hautreaktionen oder kleinen, entzündeten Knötchen (Granulome, selten Mikroabszessen) kommen.
Sind die Zecken auf dem Tierkörper unbemerkt geblieben, hat dabei eine Erregerübertragung stattgefunden und kommt es zu einer klinischen Erkrankung, gestaltet sich die Diagnose der Krankheitsursache mitunter schwieriger, da die klinischen Symptome stark variieren und recht unspezifisch sein können. Hier ist es wichtig, durch eine ausführliche Anamnese die Wahrscheinlichkeit einer früheren Zeckeninfestation zu beurteilen. Mehr diagnostische Informationen finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen.
Werden Zecken auf einem Tier entdeckt, sollten diese umgehend entfernt werden, um eine potenzielle Übertragung von Krankheitserregern möglichst zu verhindern. Zwar dauert es in der Regel viele Stunden bis Tage, bis eine Erregerübertragung stattfindet, meist ist aber unbekannt, zu welchem Zeitpunkt eine Zecke ein Tier tatsächlich befallen hat. (Mehr Informationen finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen).
Zur Entfernung von Zecken sollten geeignete Instrumente wie z. B. Zeckenzangen, -pinzetten verwendet werden, da beim Entfernen allein mit den Fingern die Gefahr besteht, dass die Zecke gequetscht wird und dadurch Krankheitserreger in den Stichkanal gedrückt werden. Öl, Alkohol, Klebstoff oder Äther sollten nicht zum Einsatz kommen.
Zecken sind in die Haut eingekittet. Man sollte sie daher gleichmäßig und nicht zu stark aus dem Stichkanal nach oben herausziehen, damit die Kittschicht langsam aufbrechen kann. Ein Drehen der Zecke wird nicht empfohlen, da dabei nicht selten die Mundwerkzeuge der Zecke in der Haut stecken bleiben. Besser ist es, die Zecke nahe an der Haut des Wirtes zu fassen und gleichmäßig von der Einstichstelle gerade heraus wegzuziehen. Es kann eine halbe Minute dauern, bis sich die Zecke löst, dann aber gleitet sie ganz leicht aus der Haut.
Entfernte Zecken müssen sorgfältig beseitigt werden, damit sie sich keinen neuen Wirt suchen können. In der Praxis ist es eine praktikable Lösung, entfernte Zecken in einen kleinen Behälter mit Alkohol oder Formalin zu verbringen und gesammelt zu entsorgen.
Nach Entfernung der Zecken wird die Anwendung eines Akarizids empfohlen, da sich nicht unbedingt alle auf dem Tier befindlichen Zecken, vor allem Larven-, Nymphenstadien und ungesogene Adulte, sicher finden und entfernen lassen. Auch anschließend sollten das betroffene Tier und alle zum Haushalt gehörenden Hunde und Katzen bis zum Ende der Zeckensaison prophylaktisch gegen Zecken behandelt werden.
Die Möglichkeit, dass Krankheitserreger bereits übertragen worden sind, sollte in Erwägung gezogen werden. Mehr Informationen dazu finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen.
Für die Behandlung sollten ausschließlich Ektoparasitika angewendet werden, die für die zu behandelnde Tierart zugelassen sind. Ist eine Umwidmung von Präparaten unumgänglich, ist die Eignung und Unbedenklichkeit des Tierarzneimittels vorab gewissenhaft zu prüfen.
CAVE: Hochkonzentriertes synthetisches Pyrethroid ist (wenn es nur für Hunde zugelassen ist) giftig für Katzen. Daher sollten derartige Präparate in Haushalten, in denen auch Katzen leben, vermieden werden.
Innerhalb Europas differieren geografische und klimatische Bedingungen erheblich, wodurch es Unterschiede hinsichtlich Prävalenz und saisonalem Auftreten der Zecken geben kann. Die Zeckenprophylaxe sollte den gesamten Zeitraum abdecken, in dem Zecken aktiv sind. Je nach individuellem Infestationsrisiko des Tieres und regionalen Vorraussetzungen für vektorübertragene Erkrankungen kann die Prophylaxe eine regelmäßige adspektorische Untersuchung der Tiere auf Zeckenbefall und/oder eine akarizide Behandlung umfassen. Hunde und Katzen, die aus endemischen Regionen stammen oder in solche verbracht werden, sollten vor der Verbringung bzw. während des Aufenthaltes mit akariziden Präparaten behandelt werden. Dies dient nicht nur dem Schutz des Tieres, sondern verhindert eine vermeidbare Verbreitung von Zecken in nicht endemische Gebiete.
Um den Erfolg der Behandlung sicher zu stellen, sollten TierhalterInnen über Wirkungsdauer und möglichen Wirkverlust (z. B. durch Schwimmen) des verschriebenen Akarizids informiert werden. So können TierhalterInnen die praktische Bedeutung von Anwendungshinweisen und Wiederholungsbehandlungen nachvollziehen, wodurch ihre Compliance gefördert wird. Eine adspektorische Untersuchung der Tiere gegen Ende der Wirkdauer wird empfohlen, um sicherzustellen, dass eventuell vorhandene Zecken umgehend entfernt werden können und gegebenenfalls eine frühzeitige Wiederholungsbehandlung erfolgt. Zu bedenken ist ferner, dass die Wirkdauer von Akariziden gegen verschiedene Zeckenarten unterschiedlich sein kann.
1) Minimales Infestationsrisiko (z. B. Tiere mit eingeschränktem oder gar keinem Auslauf im Freien):
Regelmäßige adspektorische Untersuchung der Tiere auf Zecken. Bei Befall Vorgehen wie unter Punkt 2.4.
2) Moderates Infestationsrisiko (z. B. Tiere mit regelmäßigem Auslauf und unbestimmtem Reinfestationsrisiko):
Bei Hunden und Katzen mit moderatem Infestationsrisiko wird die prophylaktische Anwendung eines Akarizids über die gesamte Zeckensaison empfohlen. Dabei ist zu beachten, dass Zecken in milden Wintern auch ganzjährig aktiv sind, was insbesondere für Regionen mit Dermacentor reticulatus-Vorkommen gilt.
3) Anhaltendes Risiko einer Reinfestation:
Bei anhaltendem Risiko für eine Reinfestation wie z. B. in Regionen mit Dermacentor reticulatus-Vorkommen oder in milden Wintern sollte eine ganzjährige Behandlung erfolgen. Bei Haltungsformen, bei denen Zecken wie R. sanguineus den Winter in Wohnräumen oder Zwingern überleben können, sollte ebenfalls eine ganzjährige Behandlung und/oder Umgebungsbehandlung erfolgen.
4) Risiko für zeckenübertragene Erkrankungen:
Grundsätzlich ist überall in Deutschland davon auszugehen, dass in den hierzulande vorkommenden Zecken pathogene Infektionserreger vorhanden sein können. Daher werden kontinuierliche Behandlungen mit dem Ziel einer konstanten Schutzwirkung empfohlen. Akarizide mit repellierender Wirkung verhindern zwar nicht, dass Zecken auf das Tier gehen, sie verhindern aber, dass die Zecken nach dem Kontakt auf dem Tier verbleiben und stechen, wodurch sich das Risiko einer Infektion mit zeckenübertragenen Krankheiten verringert. Es ist jedoch erwiesen, dass auch andere Akarizide bei der Prävention bestimmter zeckenübertragener Krankheiten erfolgreich sind, da auch diese einen Großteil der Zecken abtöten, bevor es zu einer Übertragung von Erregern kommt. Allerdings sind lediglich repellierende Akarizide geeignet, auch einen gewissen Schutz vor der Infektion mit unmittelbar nach dem Stechakt übertragenen Erregern wie z. B. dem Frühsommer-Meningo-Enzephalitis-Virus zu bieten.
5) Infestation eines Zwingers oder Haushalts:
Besteht in einem Zwinger oder Haushalt eine Infestation z. B. mit R. sanguineus oder I. canisuga, sind regelmäßige akarizide Behandlungen der Tiere in Verbindung mit einer Umgebungsbehandlung durchzuführen. Für die Umgebungsbehandlung sollte ein staatlich geprüfter Schädlingsbekämpfer hinzugezogen werden. Tier und Umgebung sind mit Wirkstoffen unterschiedlicher Wirkstoffklassen zu behandeln.
6) Haustier-Reiseverkehrsregelung (Pet Travel Scheme, PETS):
Hunde und Katzen, die nach Großbritannien, Malta oder Nordirland einreisen oder dorthin zurückkehren sollen, müssen 24 bis 48 Stunden vor ihrer Einreise durch eine Tierärztin/einen Tierarzt mit einem zugelassenen Akarizid behandelt worden sein; die Anwendung akarizid-imprägnierter Halsbänder ist dafür nicht ausreichend. Die Behandlung muss im EU-Heimtierausweis dokumentiert sein.
MASSNAHMEN GEGEN ZECKENBEFALL UND ZUR MINIMIERUNG ZECKENÜBERTRAGENER KRANKHEITEN
Hinweis: Katzen sind von zeckenübertragenen Krankheiten offenbar weniger betroffen als Hunde. In Fällen, in denen Zecken bei Katzen zum Problem werden, sollte aber auch hier eine Bekämpfung durch ein geeignetes Akarizid erfolgen.
Achtung: Hochkonzentriertes synthetisches Pyrethroid ist, wenn es nur für Hunde zugelassen ist, giftig für Katzen.
Läuse kommen beim Hund, nicht aber bei der Katze vor. Es handelt sich um dorsoventral abgeplattete, flügellose Insekten. Sie verfügen über stechende Mundwerkzeuge, saugen Blut, können Anämie hervorrufen und verursachen eine direkte Schädigung der Haut. Die in Europa für Hunde bedeutsamen Läuse gehören zu der Unterordnung Anoplura. Sie weisen eine hohe Wirtsspezifität auf. Die wichtigste Art beim Hund ist Linognathus setosus.
Haarlinge kommen bei Hunden und Katzen vor. Sie besitzen kauend-beißende Mundwerkzeuge und ernähren sich von Hautdebris. Die für Hunde und Katzen relevanten Haarlinge gehören zur Unterordnung Ischnecera und besitzen einen charakteristischen breiten Kopf. Der Hundehaarling, Trichodectes canis, fungiert als Zwischenwirt für Bandwürmer der Gattung Dipylidium. Bei der Katze ist nur eine Haarlingsart, Felicola subrostratus, relevant. Haarlinge und Läuse von Hunden und Katzen befallen den Menschen nicht.
Eine Übersicht der bei Hunden und Katzen in Europa vorkommenden Läuse und Haarlinge finden Sie in Tabelle 5.

Läuse und Haarlinge verbringen ihr ganzes Leben auf dem Wirt. Adulte Weibchen legen Eier, Nissen genannt, und befestigen diese an den Haarschäften. Im Laufe seines Lebens kann ein einziges Weibchen etwa 30–60 Eier legen. Die Larven, die bei kleinerer Größe weitestgehend aussehen wie Adulte, schlüpfen nach ungefähr 1–2 Wochen aus den Eiern. Sie machen anschließend bis zu drei Häutungen durch, bevor sie das Adultstadium erreichen. Die Übertragung erfolgt durch direkten Kontakt von Wirt zu Wirt. Der gesamte Lebenszyklus dauert etwa 3–6 Wochen und vollzieht sich vollständig auf dem Wirt.
Befall mit Läusen oder Haarlingen tritt sporadisch in den meisten Gebieten Europas auf. Die Übertragung findet durch Kontakt der Wirte statt, wobei es sich um direkten Kontakt oder indirekten Kontakt, z. B. über Gegenstände wie Bürsten und Kämme oder den Schlafplatz, handeln kann.
Ein starker Befall mit Läusen oder Haarlingen ist in der Regel durch ein schlecht gepfl egtes Fell, Nissen an den Haaren oder Adulte im Fell gekennzeichnet. Eine derartige Infestation kann Ekzeme mit Krusten und Alopezie hervorrufen. Ein Haarlingsbefall führt im Allgemeinen durch das Umherwandern der Parasiten zu ausgeprägter Irritation der Wirtstiere. Diese können unruhig oder gereizt sein und sich übermäßig kratzen und scheuern. Im Fall der Hundelaus L. setosus, die häufige Male am Tag Blut saugt, wurden auch Hautveränderungen wie Exkoriation, Urtikaria-ähnliche Läsionen und sogar nekrotische Hautveränderungen beschrieben.
Die direkten Hautschäden durch Läuse oder Haarlinge sind klinisch selten relevant, können jedoch durch bakterielle Sekundärinfektionen gravierend werden. So wurden beispielsweise einige Fälle einer pyotraumatischen Dermatitis mit Läusebefall in Verbindung gebracht. Ein starker Befall mit Läusen kann außerdem, vor allem bei Welpen, zu einer Anämie führen.
Die Diagnose eines Läuse- oder Haarlingsbefalls lässt sich durch sorgfältige Inspektion und Nachweis der Adulten oder ihrer Eier (Nissen) im Fell stellen (z. B. durch Auskämmen mit einem Floh- oder Läusekamm). Eine mikroskopische Untersuchung der adulten Ektoparasiten ermöglicht die Artidentifikation.
Hunde oder Katzen mit Läuse- oder Haarlingsbefall sollten mit einem entsprechend wirksamen Insektizid behandelt werden. Während in Deutschland eine Reihe zugelassener Produkte mit geprüfter Wirksamkeit gegen Haarlinge zur Verfügung steht, gibt es EU-weit kein Tierarzneimittel, das zur Bekämpfung gegen die Hundelaus Linognathus setosus zugelassen ist. Der Literatur sind jedoch Hinweise zu entnehmen, dass ein gegen Haarlinge wirksames Produkt auch gegen Läuse wirkt.
Zubehör von Hunden und Katzen wie Schlafkissen, Liegedecken, Bürsten, Halsbänder und Geschirre sollte regelmäßig gewaschen oder für mindestens 15 Minuten auf 60°C erhitzt oder über Nacht eingefroren werden. Zusätzlich ist die Umgebung sorgfältig zu reinigen, um eine Übertragung von Läusen und Haarlingen auf andere Tiere zu verhindern.
In Europa sind für die Tiermedizin ausschließlich Sandmücken der Gattung Phlebotomus (Schmetterlingsmücke), die vor allem im Mittelmeerraum verbreitet sind, von Bedeutung. Für die deutsche Kleintierpraxis sind sie als Ektoparasiten nur dann relevant, wenn Hunde auf Reisen in den Mittelmeerraum mitgenommen werden. Über die komplexe Biologie der Phlebotomen ist wenig bekannt, sie spielen jedoch eine außerordentlich wichtige Rolle als Vektoren für protozoäre Parasiten der Gattung Leishmania. Sandmücken übertragen Leishmania infantum. Die Leishmaniose ist eine schwere Erkrankung von Hunden und Katzen, die für diesen Parasiten als Reservoirwirt fungieren. Auch Menschen können durch L. infantum infiziert werden. Insbesondere für Kinder und Menschen mit Immundefizienz stellt die von Sandmücken übertragene Infektion mit L. infantum ein Gesundheitsrisiko dar. (Mehr Informationen finden Sie in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen).
Die im Mittelmeerraum lebenden Sandmückenarten, die L. infantum übertragen, sind Phlebotomus perniciosus, P. ariasi, P. perfi liewi, P. neglectus, P. tobbi und P. langeroni. In Zentraleuropa werden vorwiegend andere autochthone Sandmückenarten beschrieben (z. B. P. mascitii), doch ist deren Vektorkompetenz bisher noch unbekannt. Die meisten Sandmücken weisen ein breites Wirtsspektrum auf und parasitieren bei einer Vielzahl warmblütiger Tiere sowie dem Menschen.
Die Entwicklung der Sandmücken vom Ei zur adulten Form findet in Böden mit reichlich organischem Material statt. Unter günstigen Bedingungen vollzieht sich die Entwicklung vom Ei zur adulten Mücke in etwa 4–6 Wochen. Die saisonale Dynamik der Sandmücken ist noch nicht vollständig untersucht. Einige Arten legen jedoch als viertes Larvenstadium während des Winters eine Diapause ein. Bei den meisten Sandmückenarten erfolgt die Wirtssuche unmittelbar nach Sonnenuntergang. Während des Tages ziehen sich die adulten Mücken an kühle, feuchte Plätze zurück, z. B. in Risse und Löcher von Steinmauern, in dunkle Keller oder Stallungen.
Sandmücken der Gattung Phlebotomus sind im Mittelmeerraum, in Afrika und dem Mittleren Osten weit verbreitet und je nach Art an tropische, subtropische und sogar aride Lebensräume gut angepasst. Die Gebiete, in denen die Sandmückenart P. perniciosus dokumentiert wurde, haben sich im Laufe der Jahre aus dem Mittelmeerraum in Teile Norditaliens, einige Fundorte in der Schweiz und Süddeutschland sowie Belgien ausgeweitet. Sandmücken bevorzugen Windstille und ihr Flugradius ist beschränkt. Sie können jedoch durch Wind über weite Distanzen getragen werden, woraus möglicherweise ihr Vorkommen in ehemals nicht endemischen Gebieten resultiert. Da man über die natürlichen Brutplätze der Sandmücke wenig weiß, sind Maßnahmen zur Reduktion der Entwicklungsstadien unmöglich. Programme zur Bekämpfung der Leishmaniose konzentrieren sich daher auf den Hund als wichtigsten Reservoirwirt sowie die Unterbindung
der Interaktion zwischen Sandmücken und Wirt.
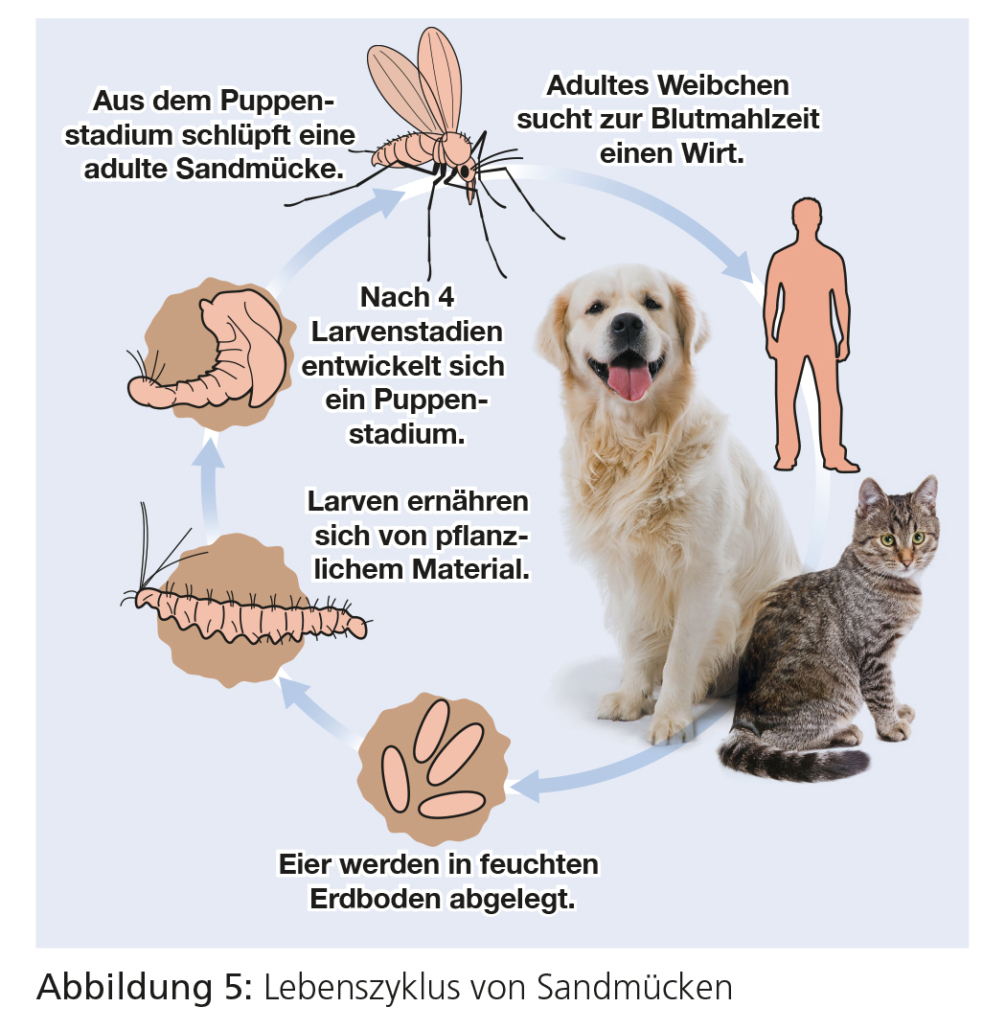
Durch den ersten Stich einer Sandmücke erfolgt typischerweise eine Sensibilisierung, so dass spätere Stiche Hautreaktionen vom Sofort- oder verzögerten Typ auslösen. Diese präsentieren sich als rosafarbene bis rote, 2–3 mm große Papeln, die einige Tage auffällig bleiben, bevor sie sich nach und nach zurückbilden. Der moderate bis starke Juckreiz führt zu Kratzen und Selbsttraumatisierung mit möglichen bakteriellen Sekundärinfektionen. Die Stiche finden sich überwiegend an dünn behaarten Körperstellen im Bereich des Fangs, um die Augen und an den Ohren. Bei Menschen, die in endemischen Gebieten leben, ist eine Desensibilisierung ausführlich beschrieben. Hunde werden aufgrund von Sandmückenstichen selten zur tierärztlichen Untersuchung vorgestellt, so dass hier der Nachweis einer Leishmania-Infektion der einzige Hinweis auf eine erfolgte Interaktion zwischen Sandmücke und Wirt sein kann.
Sandmücken der Gattung Phlebotomus suchen ihre Wirte überwiegend in der Dämmerung und während der Nacht auf. Sie sind temporär-periodische Ektoparasiten. Da sie ihre Blutmahlzeit schnell saugen, lassen sie sich selten direkt auf den Hunden feststellen. Der Stich der Sandmücke ist schmerzhaft, wird aber erst bemerkt, wenn die Mücke den Wirt bereits wieder verlassen hat.
Die Behandlung gegen einen Befall mit Sandmücken ist in Deutschland nur für Hunde relevant, die in endemische Gebiete reisen oder dorthin verbracht werden. Alle tierärztlichen Maßnahmen zielen darauf ab, die Interaktion zwischen Sandmücken und Wirtstieren zu minimieren und damit einen Stich zu verhindern.
Im Allgemeinen beginnt die Saison für Sandmücken in endemischen Gebieten im April eines Jahres und hält bis November an. Die Aktivität kann jedoch von Jahr zu Jahr variieren. Sie hängt ferner von der Region sowie der Verfügbarkeit geeigneter Lebensräume für Sandmücken ab.
Prophylaktische Maßnahmen gegen Stiche der Sandmücken werden empfohlen, um das Risiko einer Übertragung des Leishmaniose-Erregers zu verringern. Dazu gehören auch Maßnahmen, die eine Exposition von Hunden gegenüber Sandmücken minimieren. So sollten in Deutschland gehaltene Hunde möglichst nicht in Regionen mitgenommen werden, in denen die Leishmaniose endemisch vorkommt. Lässt sich dies nicht vermeiden, sollten die Tiere vor Ort nach Einbruch der Abenddämmerung im Haus gehalten werden. Fenster und Türen von Räumen, in denen Hunde untergebracht sind, sollten mit engmaschigen Mückennetzen gesichert werden. Darüber hinaus wird der Einsatz eines Insektizids mit repellierender Wirkung gegen Sandmücken empfohlen. Die regelmäßige Applikation dieser Wirkstoffe während der gesamten Saison der Sandmücken kann nachgewiesenermaßen das Risiko einer Infektion mit L. infantum signifikant verringern.
1) Hunde, die in endemischen Gebieten für Sandmücken leben:
Hunde, die in endemischen Gebieten leben, sollten vor Beginn und über die gesamte Dauer der Sandmückensaison mit einem gegen Sandmücken repellierend wirkenden Insektizid behandelt werden. In Punkt 4.5. genannte Verhaltensmaßnahmen sind zu ergreifen.
2) Hunde, die in endemische Gebiete für Sandmücken verbracht werden:
Hunde, die während der Sandmückensaison aus nicht endemischen Gebieten in endemische Regionen reisen, sollten rechtzeitig vor der Ankunft (bei Halsbändern mindestens eine Woche, bei Spot-On-Präparaten mindestens 24 Stunden zuvor) mit einem geeigneten, gegen Sandmücken repellierend wirkenden Insektizid behandelt werden. Die Behandlung sollte während des gesamten Aufenthalts im Endemiegebiet kontinuierlich erfolgen. In Deutschland gehaltene Hunde sollten möglichst nicht in Regionen mitgenommen werden, in denen die Leishmaniose endemisch vorkommt. Lässt sich dies nicht vermeiden, sind Verhaltensmaßnahmen wie unter Punkt 4.5. empfohlen.
Weltweit gibt es mehr als 3.500 bekannte Stechmückenarten. Während diese Mücken selbst hauptsächlich eine Belästigung für Tiere und Menschen darstellen, sind sie klinisch als Vektoren für verschiedene pathogene Erreger wie z. B. Filarien relevant. Für die deutsche Kleintierpraxis sind Stechmücken als Ektoparasiten nur dann von Bedeutung, wenn Hunde auf Reisen in den Mittelmeerraum mitgenommen werden.
In Europa sind mehr als 70 Stechmückenarten als potenzielle Zwischenwirte für Filarien der Gattung Dirofilaria bekannt. Hierzu gehören Stechmücken der Gattung Culex, Anopheles und Aedes einschließlich A. albopictus, der Asiatischen Tigermücke. Berichte über das Auftreten der aus Südostasien stammenden Asiatischen Tigermücke gibt es mittlerweile aus mehr als 20 europäischen Ländern inklusive Spanien, Frankreich, Italien, Deutschland, Schweiz sowie den Niederlanden. Die Filarien Dirofilaria immitis und D. repens, die von Stechmücken übertragen werden, sind klinisch relevante Nematoden bei Hunden und Katzen sowie beides Zoonose-Erreger.
Bei allen Stechmücken erfolgt die Entwicklung vom Ei zur Puppe im Wasser. Adulte Mücken legen ihre Eier meist im Wasser ab. Hierbei kann es sich um kleine Wasseransammlungen bis hin zu ausgedehnten Feuchtgebieten handeln. Die Larvenstadien bleiben permanent im Wasser. Die Larve pendelt zwischen dem Grund, wo sie sich von Mikroorganismen ernährt, und der Wasseroberfläche, um dort mit ihrem Atmungsapparat Sauerstoff aufzunehmen. Die Puppe nimmt keine Nahrung auf, ist aber im Gegensatz zu den meisten Puppen anderer Insekten sehr aktiv. Das Imago schlüpft nach wenigen Tagen aus dem Kokon und ist nach etwa einer Stunde flugfähig.
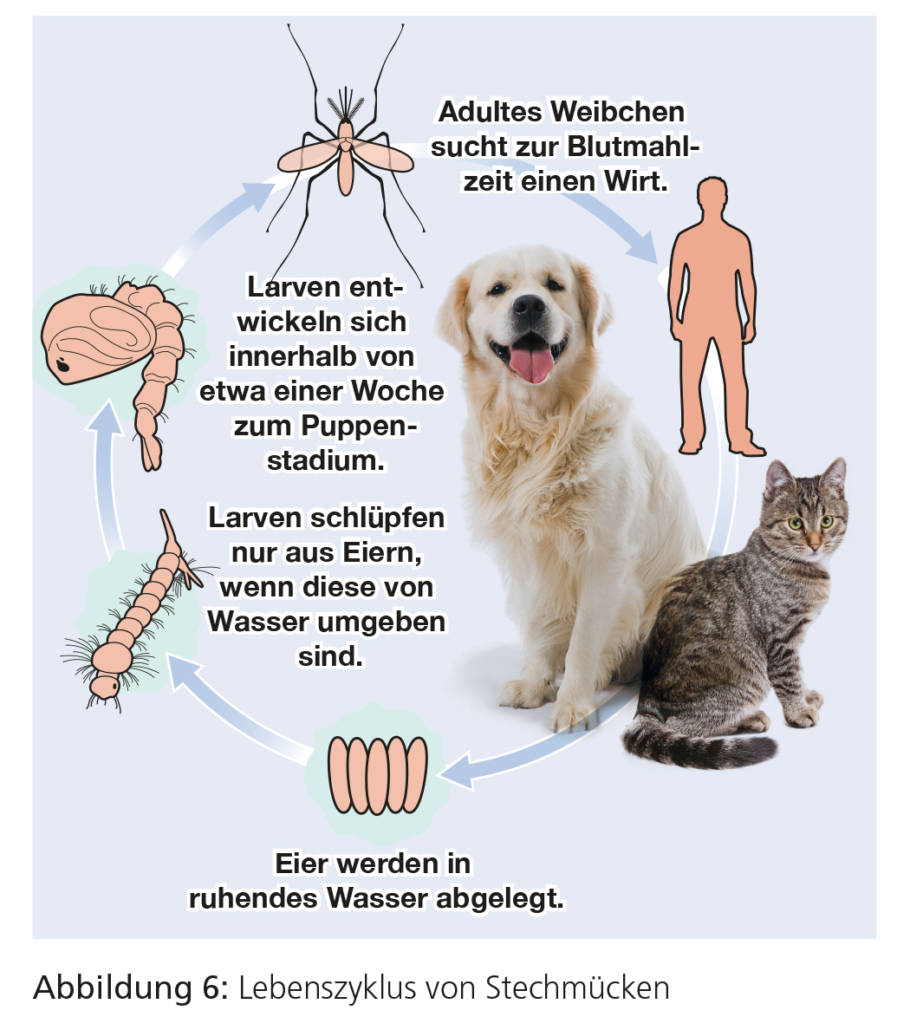
Nach dem Schlupf paaren sich die adulten Stechmücken. Bei den meisten Arten muss das Weibchen Blut saugen, um das zur Entwicklung ihrer Eierstöcke und der Eibildung notwendige Protein zu erhalten. Die Weibchen einiger Arten können auch ohne vorherige Blutmahlzeit Eier produzieren.
Männliche Stechmücken ernähren sich nicht von Blut, sondern von pflanzlichen Säften und leben nach der Paarung nur noch kurze Zeit. Einige Arten überwintern im Eistadium. Die Larven warten mit ihrem Schlupf, bis sich mit dem Temperaturanstieg im Frühjahr das Wasser erwärmt. Bei anderen Gattungen (Anopheles, Culex) verbringen die Weibchen nach der Paarung den Winter an geschützten, kühlen Plätzen. An warmen Frühlingstagen suchen sie dann nach einem Wirt und starten den Lebenszyklus erneut.
Die meisten Mückenstiche sind unangenehm, aber harmlos. In der Regel kommt es als Reaktion auf den Mückenspeichel zu Juckreiz. Die größte veterinärmedizinische Bedeutung der Stechmücken liegt in der Übertragung des Herzwurms D. immitis sowie von D. repens, dem Verursacher der kutanen Dirofilariose. Stechmücken übertragen aber auch andere Erreger, vor allem Viren.
Diagnostische Maßnahmen richten sich in der Regel auf den Nachweis der von Stechmücken übertragenen Erreger bei Tieren, die in endemischen Gebieten auf Reisen waren oder aus endemischen Gebieten importiert worden sind.
Die Behandlung gegen einen Befall mit Stechmücken ist in Deutschland nur für Hunde relevant, die in Dirofilaria-Endemiegebiete reisen oder dorthin verbracht werden. Einige Insektizide mit repellierender Wirkung sind auch gegen Stechmücken wirksam. Es ist jedoch nicht empfehlenswert, sich in Endemiegebieten von D. immitis (Herzwurm) auf die Anwendung der Insektizide zu verlassen.
Zur Herzwurmprophylaxe wird stattdessen die Behandlung mit einem geeigneten Anthelminthikum empfohlen. Näheres dazu finden Sie in der ESCCAP-Empfehlung Nr. 1 zur Bekämpfung von Würmern (Helminthen) und in der ESCCAP-Empfehlung Nr. 5: Bekämpfung von durch Vektoren übertragenen Krankheiten bei Hunden und Katzen.
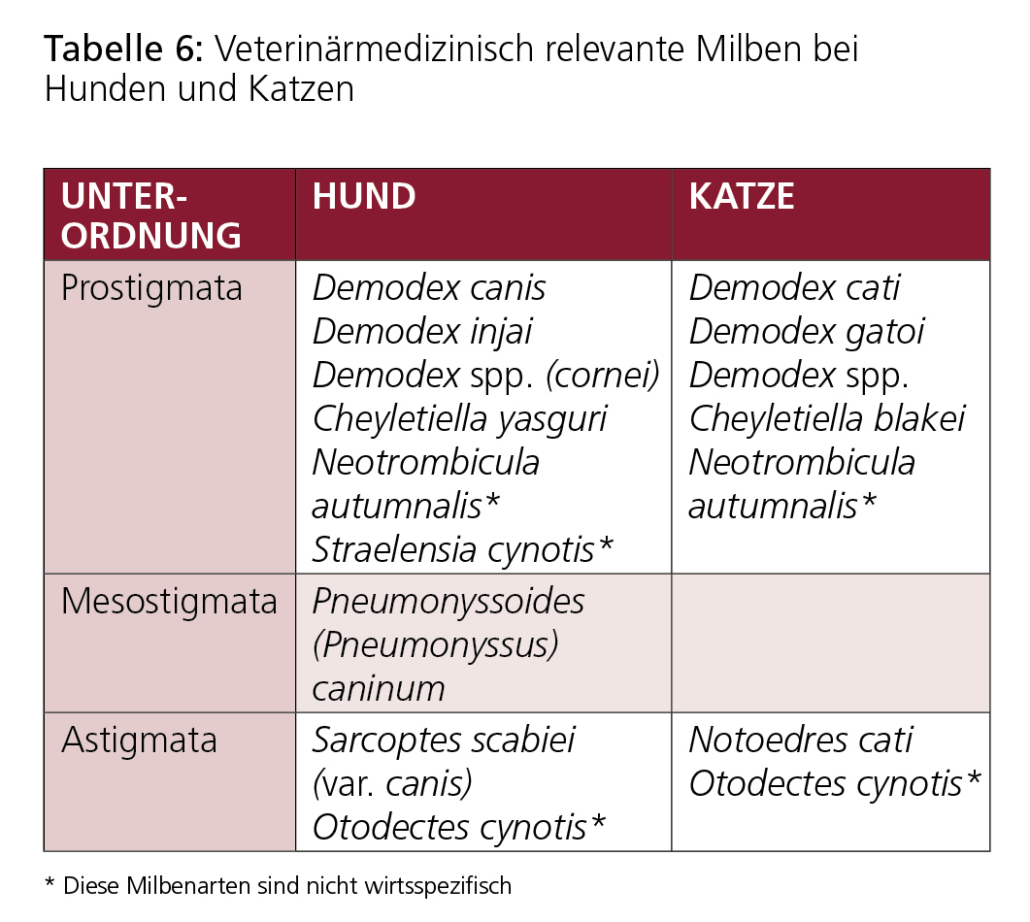
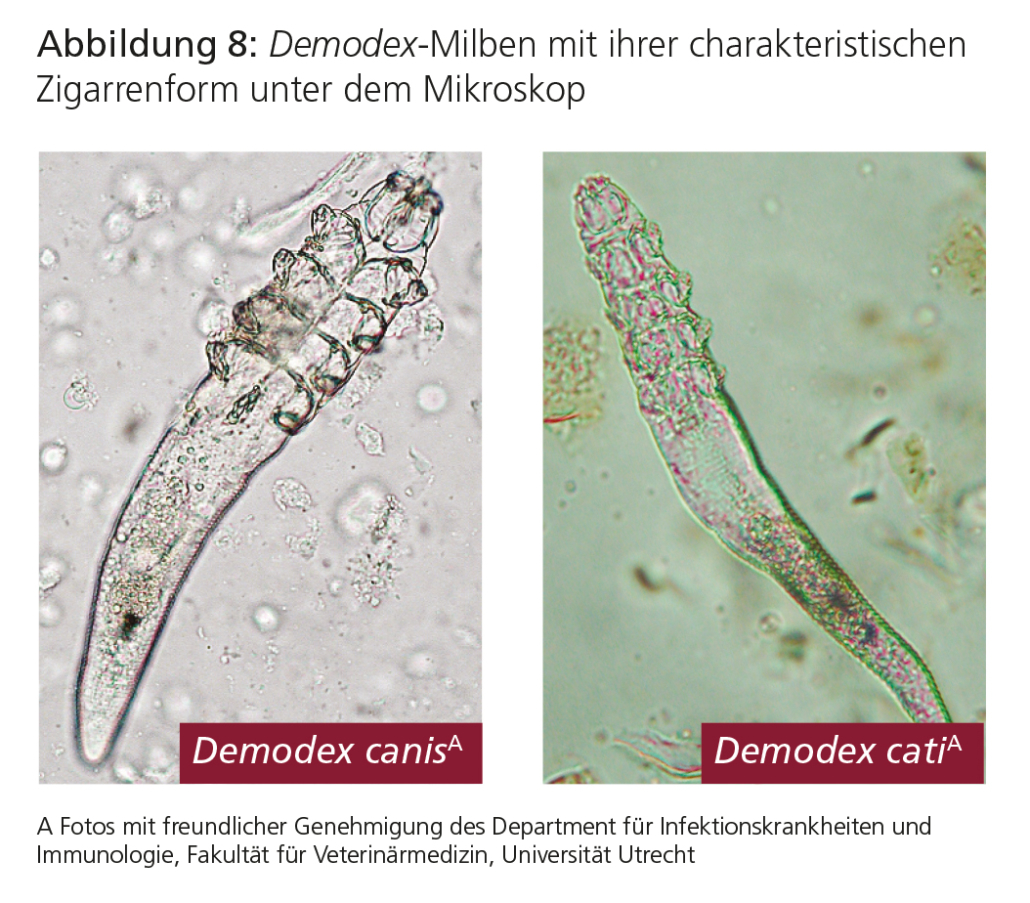
Erreger der Demodikose sind Milben der Gattung Demodex. Diese Milben werden auch als Haarbalgmilben bezeichnet. Sie haben meist eine schlanke, zigarrenförmige Gestalt mit acht Stummelbeinen bei Adultstadien.
Beim Hund handelt es sich dabei in erster Linie um Demodex canis. Die weiblichen Milben dieser Art sind etwa 0,3 mm, die männlichen etwa 0,25 mm lang. Die spindelförmigen Eier sind etwa 70–90 μm x 19–25 μm groß.
Bei der Katze ist Demodikose sehr selten. Die Demodikose der Katze wird in erster Linie von Demodex cati verursacht. Diese Milbe ist etwas länger und schlanker als D. canis.
Tabelle 6: Veterinärmedizinisch relevante Milben bei Hunden und Katzen
Bei Demodex canis-Milben handelt es sich um stationär-permanente Parasiten, deren gesamte Entwicklung im Lumen von Haarfollikeln stattfindet. Bei starkem Befall besiedeln sie jedoch auch die Talgdrüsen. Die Milbenweibchen bei D. canis legen 20–24 Eier, aus denen sich innerhalb von drei bis vier Wochen über zwei sechsbeinige Larvenstadien und zwei achtbeinige Nymphenstadien die adulten Milben entwickeln. Die feline Demodikose ist eine selten vorkommende Erkrankung. Der Lebenszyklus von D. cati ähnelt dem von D. canis. Demodex gatoi lebt vorwiegend im Stratum corneum.
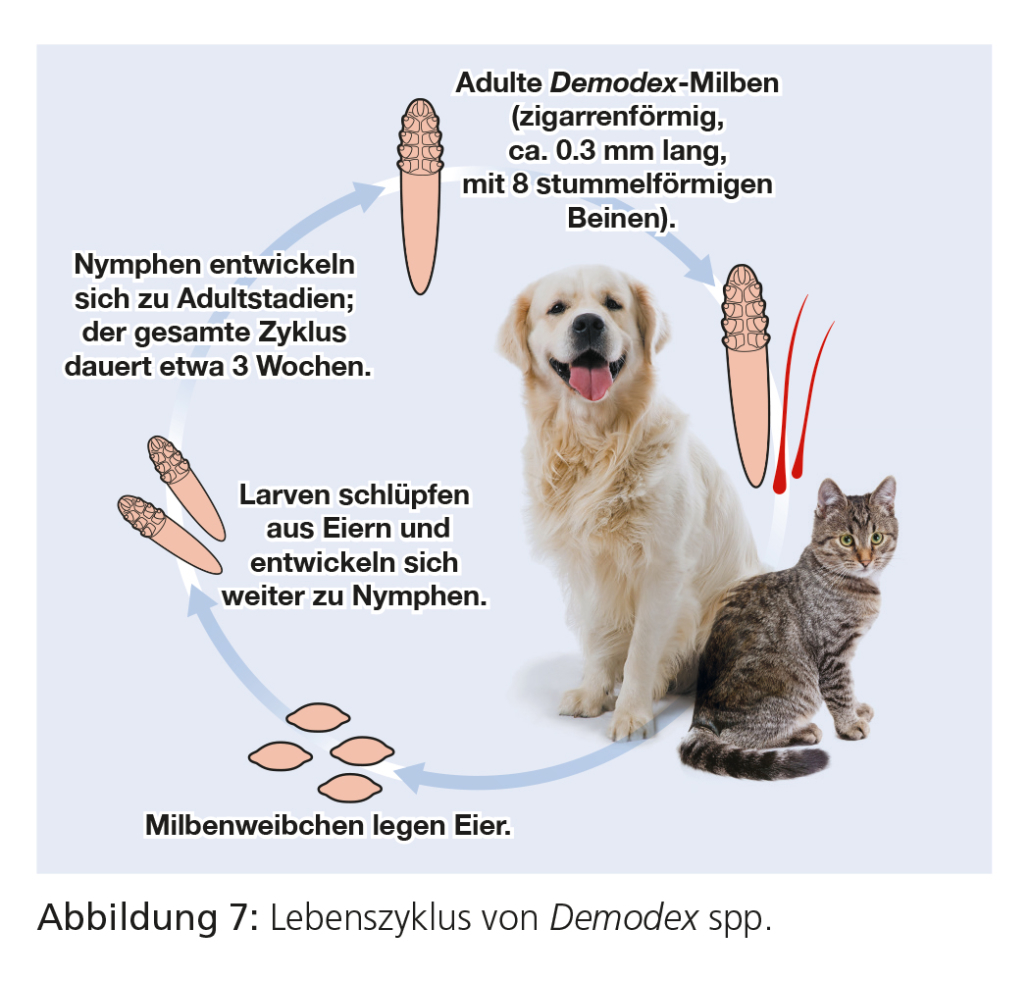
Demodex-Milben werden als Bestandteil der physiologischen Fauna der Haut betrachtet. In geringer Zahl können sie vor allem bei Hunden nachgewiesen werden, ohne dass es zu klinischen Erscheinungen kommt. Die Demodikose, verursacht durch D. canis, ist besonders unter jungen Hunden weit verbreitet. Die Übertragung erfolgt bei diesen von der Hündin auf die neugeborenen Welpen innerhalb der ersten Lebenstage durch direkten Körperkontakt. Die meisten Tiere, die eine klinisch manifeste Demodikose entwickeln, sind juvenile Tiere mit einem genetisch bedingten Immundefekt oder aber adulte Tiere, die durch eine vorliegende Grunderkrankung oder andere Faktoren (z. B. immunsuppressive Therapie, Endokrinopathie, Neoplasie) in ihrer Abwehr geschwächt und prädisponiert sind. Aus diesem Grund sollten adulte Tiere mit einer klinisch manifesten Demodikose sorgfältig auf eventuell vorliegende Grunderkrankungen untersucht werden. Demodex gaoti kann zwischen erwachsenen Katzen übertragen werden.
Demodikose tritt entweder als lokalisierte oder als generalisierte Hauterkrankung auf. Weiterhin lässt sich klinisch eine squamöse Form von der sehr viel schwerwiegenderen pustulösen Form abgrenzen. Erste Milben und eventuell erste Läsionen sind meist im Bereich der Schnauze, der Augenlider, der Stirn und der Ohren zu finden.
Die lokalisierte Demodikose wird vor allem bei Hunden beobachtet, die jünger als sechs Monate sind. Die Erkrankung kann aber auch bei adulten Tieren auftreten. Es handelt sich dabei um eine oder mehrere umschriebene, trockene, schuppige, teilweise haarlose Stellen, die besonders im Kopfbereich und an den Vorderbeinen zu finden sind. Juckreiz ist zunächst meist nicht zu beobachten, kann sich aber im Zuge einer Pyodermie durch bakterielle Sekundärinfektionen entwickeln. Die lokalisierte Demodikose des Hundes ist in der Regel keine schwere Erkrankung und heilt oft spontan innerhalb von sechs bis acht Wochen ohne Behandlung ab, und es kommt aufgrund einsetzender Immunität nur selten zu Rezidiven.
Die generalisierte Demodikose kann beim Junghund oder beim adulten Hund auftreten. Die juvenile generalisierte Demodikose tritt üblicherweise bei Hunden zwischen dem 2. und 18. Lebensmonat auf, wobei dieses Alter keine absolute Obergrenze darstellt. Auch sobald zwei Pfoten des Hundes betroffen sind, ist davon auszugehen, dass es sich um eine generalisierte Form der Demodikose handelt.
Es gibt Hinweise auf eine genetische Prädisposition für eine juvenile generalisierte Demodikose; daher sind Zuchthunde, die selbst oder deren Welpen eine generalisierte Demodikose entwickelt hatten, aus der Zucht zu nehmen.
Bei ausgewachsenen Hunden tritt die generalisierte Demodikose selten auf, ist dann aber eine schwere Erkrankung. Meist sind Hunde im Alter von über vier Jahren betroffen. Diese Form entwickelt sich nach einer massenhaften Vermehrung der Milben, meist infolge einer schwächenden Grunderkrankung wie z. B. einer Nebennierenrindenüberfunktion, Schilddrüsenunterfunktion, bestimmten Infektionskrankheiten und Tumoren oder einer lang andauernden Immunsuppression.
Die generalisierte Demodikose kann zu Beginn squamös sein, entwickelt sich jedoch häufig zu einer schweren Erkrankung, die in der Regel durch eine bakterielle Infektion kompliziert wird. Betroffene Hunde haben häufig einen unangenehmen Hautgeruch. Die Krankheit kann lebensbedrohlich verlaufen. Zugrunde liegende Krankheiten, die immunsuppressiv gewirkt haben, sollten diagnostiziert und entsprechend behandelt werden, um auch die Demodikose erfolgreich zu therapieren.
Bei Katzen kommt die durch D. cati verursachte Demodikose selten vor und wenn, dann in der Regel im Zusammenhang mit anderen Erkrankungen wie Diabetes mellitus, Neoplasien, FeLV oder FIV, die das Tier schwächen.
Katzen mit D. gatoi leiden unter Juckreiz und können betroffene Hautpartien stark lecken oder putzen. Die ebenfalls seltene D. gatoi-Dermatitis steht nicht in Zusammenhang mit bestehenden Grundleiden; die Milben können von Katze zu Katze übertragen werden.
Zum Nachweis der Demodex-Milben werden tiefe Hautgeschabsel entnommen. Zur Entnahme des Geschabsels sollte eine Hautfalte aufgezogen und fest zusammengepresst werden, um die Milben aus den Haarbälgen und Talgdrüsen herauszupressen. Das Geschabsel muss so tief genommen werden, dass es zu kapillären Blutungen kommt. Die Haut oder das Entnahmebesteck können mit Öl befeuchtet werden. Das Geschabsel wird mikroskopisch auf Demodex-Milben untersucht. Bei langhaarigen Hunden wird der Entnahmeort zuvor geschoren, um einen Verlust des Probenmaterials im Fell zu
verhindern.
Ist die Entnahme eines Hautgeschabsels in bestimmten Körperregionen nicht gut möglich (z. B. Pfoten), können Haare von einer klinisch veränderten Stelle (Areal) ausgezupft werden. Diese Haare werden mit etwas Öl auf einen Objektträger gegeben und mikroskopisch untersucht. Um die Sensitivität zu erhöhen, sollten möglichst Haare von einem Areal von rund 1 cm2 gezupft und untersucht werden. Mikroskopisch werden die charakteristischen zigarrenförmigen Milben oder ihre spindelförmigen Eier nachgewiesen (Abb. 8). Klinische Veränderungen können erst dann mit einer Demodikose ursächlich assoziiert werden, wenn mehrere Demodex-Milben, vor allem Eier oder Larven, nachgewiesen wurden. In Einzelfällen kann der Nachweis schwierig sein, z. B. bei Shar Peis und Hunden mit Pododemodikose. In diesen Fällen kann eine Biopsie notwendig sein.
In Fällen mit einer gleichzeitig vorliegenden tiefen Pyodermie kann der Inhalt aus Pusteln oder fistelartigen Gängen herausgepresst, mit Öl versetzt und mikroskopisch ebenfalls auf Milben untersucht werden.
In den meisten Fällen heilt die lokalisierte Demodikose innerhalb von sechs bis acht Wochen ohne Behandlung ab. Aus diesem Grund sollte eine lokalisierte Demodikose nicht mit Akariziden behandelt werden. Wird eine Behandlung gewünscht, kann eine lokale Anwendung von Benzoylperoxid (max. 2–3%ig) vorgenommen werden. Derzeit gibt es keinen experimentellen Beweis dafür, dass die Applikation von Akariziden den Heilungsprozess einer lokalisierten Demodikose beschleunigt.
Der Einsatz von glukokortikoidhaltigen Präparaten oder von Präparaten, die über Glukokortikoidrezeptoren wirken (z. B. Progestagene), ist absolut kontraindiziert, da er zur Generalisierung der Demodikose führen kann. Es sollte eine generelle Untersuchung des Tieres stattfinden, mit besonderem Augenmerk auf Faktoren, die das Immunsystem negativ beeinflussen können, wie eine schlechte Haltung, Ernährung sowie ein Befall mit Endoparasiten bzw. andere Grunderkrankungen. Eine klinische Untersuchung mit wiederholten Hautgeschabseln sollte vier Wochen nach der ersten Diagnosestellung erfolgen, um die Entwicklung der Krankheit zu beobachten.
Die generalisierte Demodikose bedarf einer akariziden Therapie. Auch Grunderkrankungen müssen herausgefunden und therapiert werden. Vor der Einleitung von therapeutischen Maßnahmen sollten alle Faktoren ermittelt werden, die den Gesundheitszustand des Tieres beeinflussen, und alle zugrundeliegenden Krankheiten oder Zustände sollten ermittelt und entsprechend behandelt werden. Die Prognose und die mögliche Notwendigkeit einer kostspieligen und langfristigen Therapie müssen mit der Besitzerin/dem Besitzer besprochen werden.
Therapeutisch ist der Einsatz eines Akarizids und, sofern eine Pyodermie vorliegt, eine lokale und antimikrobielle Therapie essenziell; bei schwer betroffenen Hunden kann zusätzlich eine systemische Antibiose nötig sein. Bei vielen Hunden kann damit bei einer durchschnittlichen Behandlungsdauer von drei Monaten eine Heilung erreicht werden. Es wird die Überwachung des Behandlungserfolgs durch monatliche Hautuntersuchungen empfohlen. Es gibt Hunde, bei denen trotz deutlicher klinischer Besserung mikroskopisch Milben nachweisbar bleiben. Die Behandlung sollte bis mindestens acht Wochen nach dem ersten negativen Hautgeschabsel fortgesetzt werden. Es sollte abgeklärt werden, welche zu Grunde liegende Erkrankung ggf. das Entstehen der Demodikose hervorgerufen hat. Die Verwendung von Glukokortikoiden während der klinisch bestehenden Demodikose vermieden werden. Ein Tier wird als komplett geheilt betrachtet, wenn innerhalb von zwölf Monaten nach Beendigung der Therapie kein Rezidiv auftritt. Rezidive treten meist dann auf, wenn die Behandlung nicht konsequent durchgeführt wurde.
Derzeit sind in Deutschland für die Behandlung der Demodikose mit Afoxolaner, Fluralaner und Sarolaner Wirkstoffe aus der Gruppe der Isoxazoline sowie das makrozyklische Laton Moxidectin zugelassen. Dabei erwiesen sich die Isoxazoline in Studien als überlegen.
Die lokalisierte Demodikose bei Katzen heilt in den meisten Fällen spontan ab, während die generalisierte Demodikose behandelt werden muss. Für Katzen gibt es derzeit kein zugelassenes Präparat gegen Demodikose. In Fallstudien wurden Hinweise auf eine gute Wirkung von Isoxazolinen wie Fluralaner und Sarolaner bei feliner Demodikose gewonnen. Bei der Katze tritt die Demodikose oft infolge einer Grunderkrankung auf, die diagnostiziert und behandelt werden sollte.
Da Demodex-Milben wirtsspezifisch sind, birgt eine Demodikose bei Hund und Katze keine Zoonosegefahr.
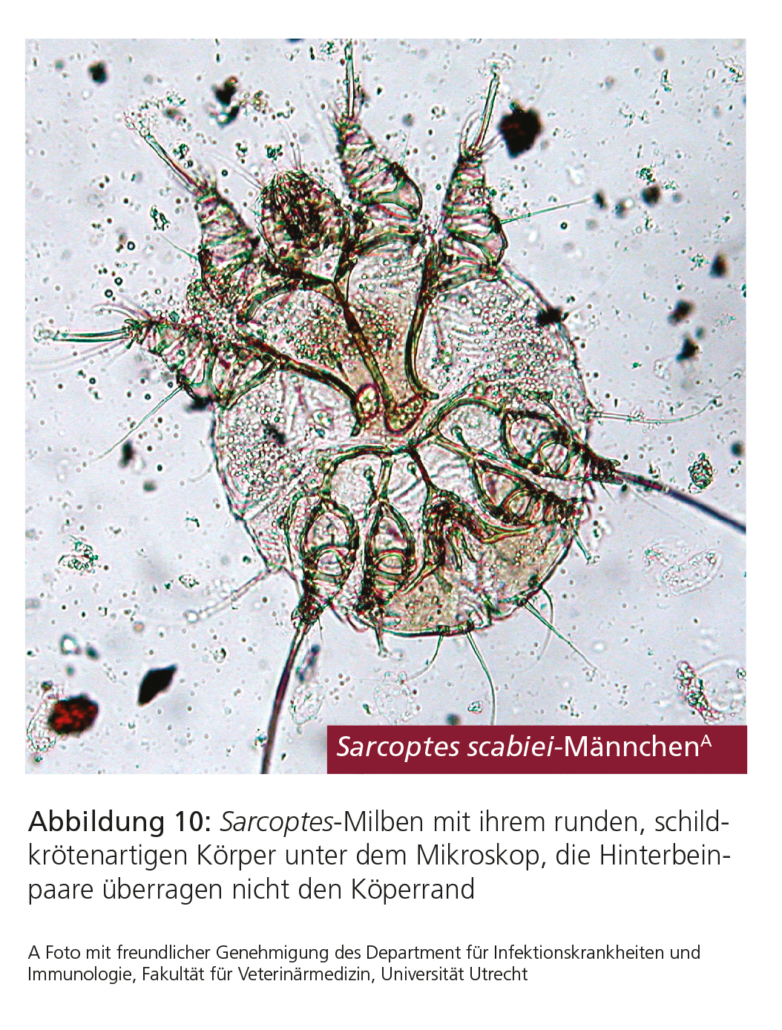
Eine Übertragung von Sarcoptes-Milben findet in erster Linie durch engen Kontakt statt. Sarcoptes-Milben sind obligate Parasiten, deren gesamter Lebenszyklus auf dem Wirt stattfindet. Sarcoptes scabiei (varietas [var.] canis) ist der Erreger der kontagiösen und mit starkem Juckreiz einhergehenden Sarcoptes-Räude beim Hund. Die adulten Milben haben einen runden, schildkrötenähnlichen Körper und sind klein (0,2–0,4 mm Durchmesser); ihre beiden Hinterbeinpaare überragen nicht den Körperrand.
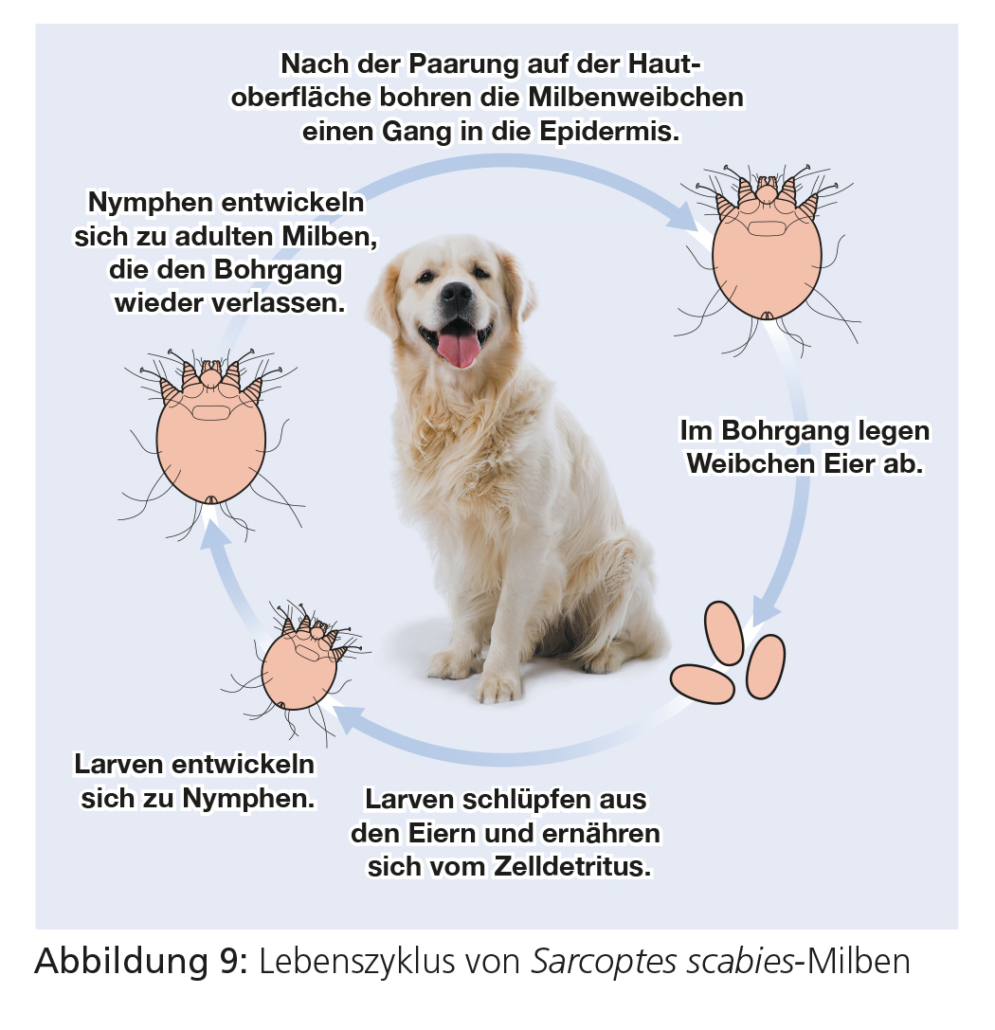
Die adulten Milben leben in Bohrgängen in der oberen Hautschicht. In den Bohrgängen legt das Weibchen über mehrere Monate Eier ab. Aus den Eiern schlüpfen sechsbeinige Larven, die sich über zwei Nymphenstadien zu adulten Milben entwickeln. Die Entwicklung vom Ei bis zur adulten Milbe dauert zwei bis drei Wochen.
Die Sarcoptes-Räude ist hoch ansteckend. Eine Milbenübertragung erfolgt durch direkten Körperkontakt von Tier zu Tier oder indirekt über milbenkontaminierte Umgebung. Sarcoptes-Milben können unter günstigen Bedingungen (kühl und feucht) für zwei bis drei Wochen außerhalb des Wirts z. B. im Hundekorb oder in Bürsten überleben. Da sie in Fuchspopulationen weit verbreitet sind, können sich Hunde, die mit Füchsen Kontakt hatten oder in Fuchsbauten eindrangen, leicht anstecken. Klinisch manifeste Krätze-Fälle beim Menschen sind nach Kontakt mit Sarcoptes-befallenen Tieren keine Seltenheit.
Äußeres Ohr, Schnauze, Bauch, Ellbogen und Sprunggelenke sind Prädilektionsstellen für S. scabiei; bei schweren Erkrankungen dehnt sich der Befall auf den ganzen Körper aus. Erste Läsionen sind Erytheme und Papeln (akute Räude), später folgen Hautverdickungen mit borkigen Belägen, Faltenbildung und Haarausfall. Es besteht ein starker Juckreiz mit Kratzen und daraus folgenden Verwundungen. Schon bevor Läsionen sichtbar sind, können Hunde einen Juckreiz entwickeln. Es wird vermutet, dass sich die Intensität des Juckreizes durch eine Überempfindlichkeitsreaktion auf Milbenallergene verschlimmert. Ohne Behandlung schreitet die Erkrankung fort und die Läsionen verbreiten sich über die gesamte Hautoberfläche. Betroffene Hunde können stark abmagern.
Ein wichtiger diagnostischer Hinweis auf Sarcoptes-Räude beim Hund ist der meist vorhandene und oft sehr stark ausgeprägte Juckreiz. Hunde mit Sarcoptes-Räude zeigen in der Regel einen Kratzreflex, sobald ihr Ohrrand von der Untersucherin/vom Untersucher gerieben wird (Pinna-Pedal-Reflex).
Zur Bestätigung der klinischen Verdachtsdiagnose sollten mehrere oberflächliche, großflächige Hautgeschabsel genommen und auf Sarcoptes-Milben untersucht werden (Abb. 10). Die Sensitivität soll deutlich erhöht werden, wenn vor der Geschabselentnahme Öl auf die betroffene Hautregion aufgetragen wird.
Ist das Ergebnis der Geschabseluntersuchung negativ, ein Sarcoptes-Verdacht aber weiterhin begründet, kann vor Beginn einer Therapie eine serologische Untersuchung auf Sarcoptes-spezifische Antikörper vorgenommen werden. Dafürstehen verschiedene kommerzielle ELISA-Tests zur Verfügung, die sich in ihrer Qualität allerdings unterscheiden. Kreuzreaktionen mit Hausstaubmilben können auftreten. Ferner muss berücksichtigt werden, dass Sarcoptes-spezifische Antikörper frühestens fünf Wochen nach einer Infektion nachweisbar und noch mehrere Monate nach erfolgreicher Therapie festzustellen sind. Außerdem sollten die serologischen Befunde immer unter Berücksichtigung der klinischen Symptome und anderer diagnostischer Befunde bewertet werden.
Aufgrund der geschützten Prädilektionsstellen der Milben innerhalb der Haut, ihres Lebenszyklus und auch um alle Milben abzutöten sowie ein Neuauftreten der Veränderungen zu verhindern, ist eine systemische Therapie erforderlich. Zur Behandlung der Sarcoptes-Räude sind in Deutschland gegenwärtig Isoxazoline wie Afoxolaner, Fluralaner und Sarolaner zugelassen. Außerdem sind Selamectin oder Moxidectin zugelassen. Eine kurzzeitige Behandlung mit einem Kortikosteroid und/oder Waschungen mit einem kortikoidhaltigen Shampoo können zur Linderung des Juckreizes erwogen werden.
Vor und während der gezielten topikalen Behandlung mit akariziden Wirkstoffen sollten durch entsprechende Waschungen die Krusten aufgeweicht und entfernt werden.
Da die Sarcoptes-Räude hoch ansteckend ist, müssen in Haushalten mit mehreren Hunden alle Kontakttiere behandelt werden, um wechselseitigen Neuinfektionen vorzubeugen. Die Tiere sollten mindestens fünf Tage lang keinen Kontakt mit fremden Hunden haben, und bereits zuvor stattgefundene Kontakte sollten über die Möglichkeit einer Übertragung informiert werden.
In Haushalten mit mehreren Hunden und Zwingern ist es ratsam, alle Tiere zu behandeln, die miteinander Kontakt haben.
Liegeplätze sollten regelmäßig gereinigt und desinfiziert sowie Liegedecken etc. bei 60°C gewaschen oder für mindestens 15 Minuten auf 60°C erhitzt werden. Beim Umgang mit betroffenen Hunden sollten Handschuhe getragen werden, um eine Übertragung zu verhindern.
Sarcoptes-Räude ist bei der Katze sehr selten; der Verlauf ähnelt jenem beim Hund. Die klinischen Anzeichen in solchen Fällen ähneln denen der Notoedres-Räude.
Sarcoptes-Milben sind leicht auf den Menschen übertragbar und verursachen bei diesem eine klinisch manifeste (Trug-)Krätze bei der die Milben ihre Entwicklung in der Regel nicht fortführen können.
Notoedres cati verursacht bei Katzen eine Hauterkrankung, die der Sarcoptes-Räude des Hundes gleicht. Diese Milbenart wurde gelegentlich auch u. a. bei Hunden, Kaninchen und Hamstern nachgewiesen. Bei Menschen kann es zu vorübergehenden Hautentzündungen kommen.
Die Entwicklung von N. cati ist der von S. scabiei insofern ähnlich, als der gesamte Entwicklungszyklus auf dem Wirt vollzogen wird und sich die adulten Weibchen in gewundenen Gängen oberflächlich in die Haut einbohren. Die Gesamtentwicklung vom Ei bis zur adulten Milbe dauert knapp drei Wochen.
Die Notoedres-Räude ist hoch ansteckend. Eine Milbenübertragung erfolgt durch direkten Körperkontakt von Tier zu Tier oder indirekt über milbenkontaminierte Umgebung. Notoedres-Milben können unter günstigen Bedingungen (kühl und feucht) für zwei bis drei Wochen abseits des Wirtes z. B. im Katzenkorb oder in Bürsten überleben.

Frühe Symptome sind der lokal begrenzte Haarausfall und Erytheme an Ohrrändern und im Gesicht. Die Haut bildet gräulich-gelbe Krusten und schuppt. Es besteht extremer Juckreiz; heftiges Kratzen verursacht oft Hautverletzungen und bakterielle Sekundärinfektionen. Unbehandelt kann die Krankheit schwer und letal verlaufen.
Charakteristisch sind stark juckende Läsionen um Kopf und Ohren. Die kleinen runden Notoedres-Milben mit ihren charakteristischen konzentrischen „Daumenabdruck“-Rücken-streifen lassen sich mikroskopisch relativ leicht in Hautgeschabseln nachweisen.
Derzeit sind in Deutschland die makrozyklischen Laktone Moxidectin und Eprinomectin, eine Fipronil-Kombination zur Behandlung der Notoedres-Räude der Katze zugelassen sowie ein das Bispyrazol Tigolaner enthaltende Kombinationsprodukt. Es ist wichtig, alle Kontakttiere zu behandeln und kontaminierte Decken und Schlafplätze zu reinigen bzw. auszutauschen. Bei frühem Behandlungsbeginn ist die Prognose gut.
In Ausnahmefällen kann Notoedres cati beim Menschen vorübergehend eine (Trug-)Krätze verursachen.
Die sogenannte Ohrmilbe Otodectes cynotis verursacht bei Hunden und Katzen eine Otitis externa. Es kann sowohl einseitiger als auch beidseitiger Befall auftreten. In einigen Fällen können sich die Milben über den gesamten Körper ausbreiten und eine Dermatitis verursachen.
Otodectes cynotis (0,3–0,5 mm großer, längsovaler Körper mit langen Beinen) vollzieht seinen gesamten Lebenszyklus auf dem Wirt, dieser dauert etwa drei Wochen. Die Ansteckung erfolgt meist durch direkten Körperkontakt. Otodectes-Milben können leicht von Hunden auf Katzen und umgekehrt übertragen werden. Sie können abseits eines Wirtes in feuchter Umgebung für mehrere Wochen überleben.

Ohrmilben können in jeder Altersgruppe von Hunden oder Katzen auftreten, sind jedoch bei Welpen häufiger als bei ausgewachsenen Tieren. Katzen sind häufiger befallen als Hunde. Die Milben leben an der Oberfläche und können als bewegliche, weiße Punkte im äußeren Gehörgang gesehen werden. Der Befall mit O. cynotis geht typischerweise mit der Absonderung eines braunen, kaffeesatzartigen Ohrsekrets einher. Gelegentlich verläuft ein Ohrmilbenbefall ohne klinische Veränderungen, häufig besteht jedoch Juckreiz. Betroffene Tiere kratzen sich an den Ohren. Ohrmuschel und äußerer Gehörgang sind gerötet. In Einzelfällen können sich die Milben auch an anderen Körperstellen aufhalten und dort Juckreiz hervorrufen. Es kommt oft zu sekundären bakteriellen oder Pilzinfektionen, wodurch sich die Krankheitsausprägungen verschlechtern können.
Die Diagnose kann durch otoskopische Untersuchung gestellt werden, wenn das typische braune, kaffeesatzartige Sekret gefunden wird und sich bewegende Milben beobachtet werden. Falls notwendig, kann eine Probe des Ohrsekretes entnommen und mikroskopisch untersucht werden. Da der Gehörgang entzündet sein kann, wodurch eine Probenentnahme schmerzhaft werden könnte, sollte darauf geachtet werden das Tier entsprechend festzuhalten. Der Watteträger sollte auf einen Objektträger aufgetragen und unter geringer Vergrößerung untersucht werden. Alternativ kann auch ein Tropfen Wasser, Alkohol oder flüssiges Paraffin helfen, das Material zu lösen. Mit einem Deckglas versehen kann die Probe dann bei 40-facher Vergrößerung untersucht werden. Zu beachten ist, dass bei purulenten Ohrentzündungen oft keine Milben mehr nachweisbar sind.
Für die Behandlung der Ohrräude sind in Deutschland beim Hund Präparate mit den Wirkstoffen Sarolaner sowie Moxidectin und Selamectin zugelassen, bei der Katze zusätzlich noch Fluralaner, ein Ivermectin-haltiges Ohrgel, Esafoxolaner und Tigolaner. Für die rein lokale Behandlung beim Hund sind ferner Akarizid-freie bzw. u. a. Glukokortikoid-haltige Ohrentropfen zugelassen, mit denen oft gute Erfolge erzielt werden können. Alle Hunde und Katzen eines Haushalts oder Zwingers sind in die Therapiemaßnahmen mit einzubeziehen. Beim Umgang mit betroffenen Hunden sollten Handschuhe getragen werden, um eine Übertragung zu verhindern.
Otodectes cynotis kann selten auch auf den Menschen übergehen und zu einer Dermatitis führen.
Milben der Gattung Cheyletiella können Hunde (Cheyletiella yasguri) und Katzen (Cheyletiella blakei) befallen. Während der Befall von einigen Tieren gut toleriert wird, kann er bei anderen Tieren zu Hautirritationen führen.
Cheyletiella-Milben sind etwa 0,3–0,5 mm groß und haben einen sechseckigen Körper. Ihre Mundwerkzeuge sind kräftig, die Beine ragen über den Körperrand hinaus.
Die Milben leben im Fell des Wirtes und die weiblichen Milben legen Eier in das Fell. Die Gesamtentwicklung über Ei, Larven, Nymphen bis zu Adulten dauert etwa drei Wochen und wird vollständig auf dem Wirt vollzogen. Cheyletiella-Milben können bis zu zehn Tage in der Umgebung überleben.
Die Ansteckung erfolgt zwischen Tieren mit engem Kontakt sehr leicht und schnell, junge und schwache Tiere scheinen besonders empfänglich zu sein. In Zwingernist die Cheyletiellose besonders verbreitet.

Ein Cheyletiella-Befall verursacht bei manchen Tieren lediglich schuppige Haut, führt bei anderen Tieren dagegen zu erythematösen, verkrusteten Läsionen und unterschiedlich starkem Juckreiz. Pelzmilben werden gelegentlich als bewegliche, weiße Punkte zwischen den Schuppen wahrgenommen.
Die Diagnose eines Pelzmilbenbefalls wird durch einen mikroskopischen Milbennachweis gestellt. Die vergleichsweise großen (0,5 mm) Milben können gelegentlich als weiße, bewegliche Gebilde mit bloßem Auge auf der Haut bemerkt werden. Zur Probenentnahme kann das Fell gebürstet, geschnitten oder gekämmt werden oder ein oberflächliches Hautgeschabsel gewonnen werden, um Haare und Schuppen zu gewinnen. Alternativ wird mithilfe eines Klebestreifens loses Material von einem betroffenen Fellareal auf einen Objektträger überführt. Die Probe kann in einer Petrischale mithilfe eines Stereomikroskops auf bewegliche Milben untersucht werden (Abb. 3). Eier von Cheyletiella spp. können auch auf Haaren sichtbar sein. Da infizierte Hunde und Katzen ihr Fell sehr stark pflegen, lassen sich abgeschluckte Eier manchmal auch in Fäzes nachweisen.

Für die Behandlung eines Cheyletiella-Befalls stehen keine zugelassenen Präparate zur Verfügung. In klinischen Studien erwiesen sich unter anderem die topische Applikation von Selamectin, Moxidectin/Imidacloprid (Spot-on) oder Fipronil (Spray) in einem monatlichen Intervall als wirksam. Studien liegen auch zur wöchentlichen oralen Gabe von Milbemycin über einen Zeitraum von drei Wochen vor. Es ist ratsam, Kontakttiere, insbesondere wenn sie derselben Art angehören, ebenfalls zu behandeln, auch wenn sie keine Zeichen eines Befalls zeigen. Die Reinigung der Umgebung einschließlich Waschen der Decken und Schlafplätze sowie Staubsaugen hilft, die Milbenkontamination zu minimieren.
Besitzer betroffener Tiere können ebenfalls von Cheyletiella-Milben befallen werden und dann eine juckende Dermatitis entwickeln.
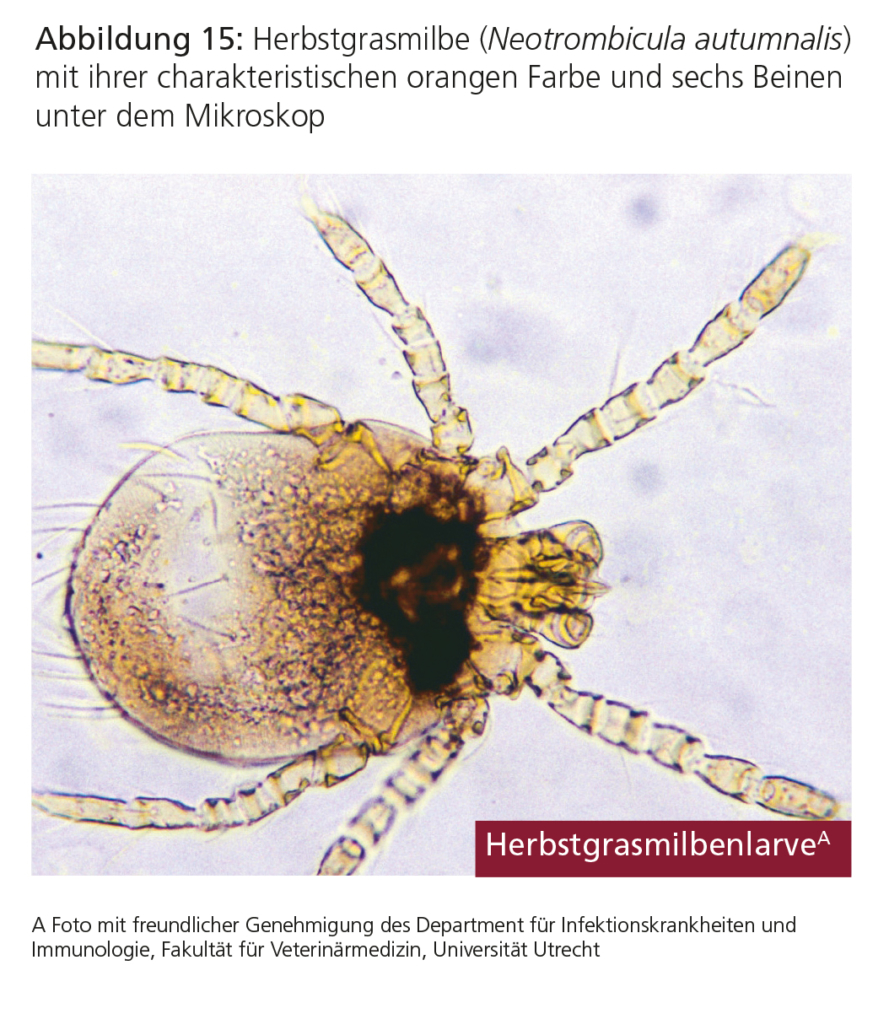
Neotrombicula autumnalis gehört zur Gruppe der Herbstgrasmilben, von denen nur die Larvenstadien parasitisch leben. Neotrombicula-Larven sind sechsbeinig, etwa 0,2–0,3 mm groß und haben charakteristisch eine orange Farbe (Abb. 15). Die Larven können auch Menschen befallen.
Die parasitischen Larven befallen Tiere direkt; eine Übertragung von Tier zu Tier erfolgt nicht. Im Früh- bis Spätsommer klettern die Larven an Grashalmen oder anderen Pflanzen hoch und befallen von dort einen vorbeikommenden Wirt. Sie halten sich mehrere Tage auf dem Wirt auf und saugen Blut; danach verlassen sie den Wirt und vollführen ihre weitere Entwicklung über Nymphen zu adulten Milben in der grünen Außenwelt. In Mitteleuropa gibt es eine Larvengeneration pro Jahr. Sie sind vor allem an sonnigen, trockenen (Spät-)Sommertagen aktiv.
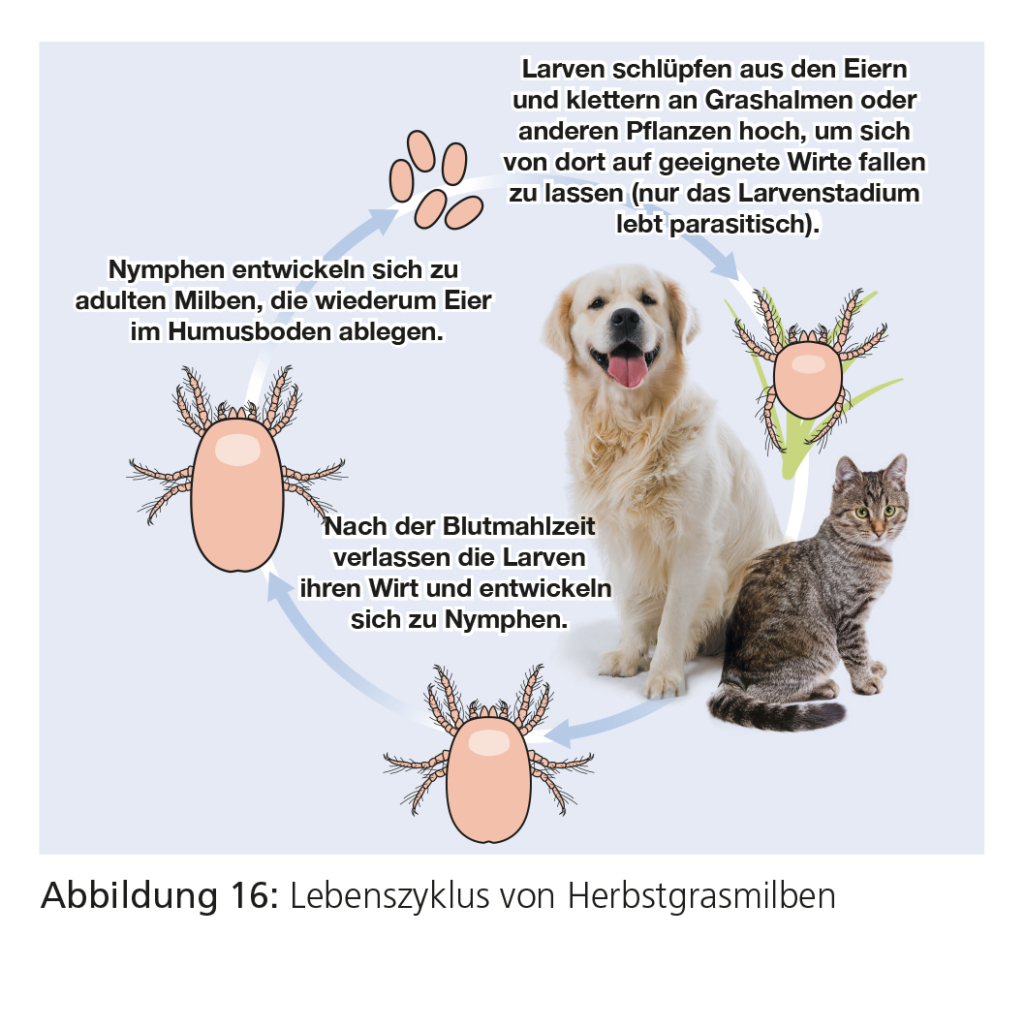
Üblicherweise werden Hautläsionen in Körperbereichen gefunden, die mit dem Boden in Kontakt kommen, also an Kopf, Ohren, Beinen, Pfoten und ventralen Bereichen wie Bauch und Brust. Die befallenen Stellen jucken stark. Makroskopisch fallen die Milbenlarven durch ihre leuchtend orange Farbe auf. Bei wiederholtem Befall kann es zu schweren Überempfindlichkeitsreaktionen kommen.
Klinische Veränderungen und Jahreszeit (Herbstgrasmilbe: meist Spätsommer bzw. Herbst) führen zur Verdachtsdiagnose. Diese wird durch den Nachweis der mit bloßem Auge gerade noch erkennbaren orangefarbenen Milben bzw. mikroskopisch abgesichert.
Zur Behandlung oder Prophylaxe eines Herbstgrasmilbenbefalls sind keine Präparate zugelassen. Erfahrungsberichte zeigen aber, dass eine lokale Applikation (Pfoten, Abdomen) akarizid wirksamer Präparate (z. B. Fipronil-Spray) Neotrombicula-Larven abtötet. Bei wiederholter Anwendung in kurzen Intervallen (drei bis fünf Tage) kann eine Milbeninfestation verhindert werden. Beim Hund können alternativ pyrethroidhaltige Präparate angewendet werden.
Bei einem bestehenden Befall kann eine juckreizstillende Medikation indiziert sein.
Vorbeugend sollten Gebiete in denen im Vorjahr Herbstgrasmilben auftraten gemieden werden.
Neotrombicula-Larven befallen auch Menschen und verursachen dann eine stark juckende Dermatitis. Die Larven werden jedoch nicht direkt von Tieren auf Menschen übertragen, sondern gelangen beispielsweise bei der Gartenarbeit auf diese.
Der Nasenmilbenbefall des Hundes wird durch Pneumonyssoides caninum verursacht. Die adulten Milbenweibchen sind relativ groß (1–1,5 mm lang, 0,6–0,9 mm breit) und makroskopisch sichtbar.
Der Lebenszyklus dieser Milbenart ist noch nicht vollständig bekannt. Es wird angenommen, dass diese Milben permanente Parasiten in Nasenhöhle und Nebenhöhlen von Caniden sind. Literaturangaben lassen vermuten, dass sich die Larven ohne Einschaltung von Nymphenstadien zu Adulten entwickeln.
Man nimmt an, dass die Übertragung von Milben direkt von Hund zu Hund erfolgt. Eine indirekte Übertragung über Decken, Schlafplätze, Transportboxen und Zwinger kann jedoch nicht ausgeschlossen werden, da die Nasenmilben bis zu 20 Tage ohne Wirt überleben können.
Ein Nasenmilbenbefall tritt bei Hunden recht häufig in skandinavischen Ländern auf. Über Einzelfälle wurde auch aus Deutschland und anderen europäischen Ländern berichtet.
Die klinischen Veränderungen variieren in Abhängigkeit von der Befallstärke. Bisweilen ist ein Nasenmilbenbefall asymptomatisch, in anderen Fällen zeigen die Hunde Nasenausfluss, Niesen („Rückwartsniesen“) und Kopfschütteln. In sehr schweren Fällen können eitrige Rhinitis und Sinusitis auftreten.
Die Diagnose in vivo ist aufgrund der unzugänglichen Lokalisation der Nasenmilben schwierig. In seltenen Fällen wird der Befall aber post mortem festgestellt.
Nasenmilben können gelegentlich im Nasensekret oder endoskopisch an ihrem Ansiedlungsort nachgewiesen werden.
Nur in Italien und Norwegen ist Milbemycinoxim zur Behandlung eines Nasenmilbenbefalls bei Hunden zugelassen. Makrozyklische Laktone wie Selamectin, Moxidectin und Milbemycin scheinen am effektivsten zu wirken, wobei drei Behandlungen im Abstand von ein bis zwei Wochen empfohlen werden.
Pneumonyssoides (Pneumonyssus) caninum ist keine Zoonose.
Maßnahmen zur Bekämpfung von Ektoparasiten müssen individuell an den Patienten angepasst werden. Bestimmte Faktoren können eine intensivere Überwachung und/oder Behandlung notwendig machen, während sich bei anderen ein weniger intensives Vorgehen rechtfertigen lässt. Bei der Empfehlung eines Programms zur Parasitenbekämpfung sollten TierärztInnen folgende Aspekte berücksichtigen:
Herkunft, Alter und Gesundheitsstatus des Tieres sind zu berücksichtigen. Jede schwächende Erkrankung kann Hunde und Katzen für eine Parasiteninfestation empfänglicher machen.
Tierheim- und Zwingerhunde, Hunde, die sich viel im Freien aufhalten, streunende sowie jagdlich eingesetzte Hunde und solche, die mit Artgenossen oder Katzen zusammenleben, haben ein größeres Risiko für einen Parasitenbefall. Gleiches gilt für Katzen in Zuchten, für freilaufende und streunende Katzen sowie solche, die zusammen mit anderen Katzen oder Hunden gehalten werden. Weitere Risikofaktoren sind Teilnahme an Ausstellungen und Wettkämpfen, der Besuch einer Tierpension oder Hundeschule.
Eine unausgewogene Ernährung kann dazu beitragen, dass ein Befall mit Ektoparasiten und/oder die klinischen Symptome schwerer ausgeprägt sind.
Bei Tieren, die in gefährdeten Gebieten leben oder dorthin verbracht werden, besteht ein erhöhtes Risiko. So sind Hunde und Katzen, die Freilauf auf Grünflächen, Wiesen oder bewaldeten Gebieten haben, gefährdeter bezüglich der Infestation mit bestimmten Zeckenarten als andere Tiere. Ein Befall mit Flöhen außerhalb des häuslichen Bereichs erfolgt oft eher in städtischen Gebieten, in denen die Populationsdichte von Hunden und Katzen am höchsten ist. Sandmücken gefährden wiederum vor allem Tiere, die aus Deutschland auf Reisen in endemische Gebiete mitgenommen werden.
Obwohl bei landwirtschaftlichen Nutztieren bereits über eine verringerte Wirksamkeit von Insektiziden und Akariziden berichtet wurde, gibt es in Europa derzeit keine belegten Fälle eines Therapieversagens aufgrund resistenter Zecken-, Milben- oder Insektenpopulationen. Besteht Verdacht auf eine Resistenz, ist zunächst eine systematische Anamnese und Untersuchung vorzunehmen, um Behandlungsfehler oder einen bei starker Infestation möglichen Restbefall als Ursache für das Therapieversagen auszuschließen. Geklärt werden muss, ob ein geeignetes Tierarzneimittel in adäquater Dosierung gemäß Anweisung zum Einsatz kam. Bestehen weiterhin Zweifel, sollten der Hersteller sowie das Bundesministerium für Verbraucherschutz und Lebensmittelsicherheit (BVL) über den vermuteten Wirkungsverlust informiert werden, damit detaillierte Untersuchungen vorgenommen werden können. Formulare für die amtliche Meldung finden sich auf den Internetseiten des BVL und der Bundestierärztekammer.
Solange nichts anderes bewiesen ist, kann davon ausgegangen werden, dass das Risiko einer Resistenzentwicklung davon abhängt, wie stark und oft eine Parasitenpopulation mit einem bestimmten Arzneimittel exponiert wird. Deshalb ist es wichtig, die Wirksamkeit von Insektiziden und Akariziden bei einer häufigen Anwendung innerhalb einer Population (z. B. Haushalt, Zucht, Zwinger, Tierheim) sachgerecht zu planen, da in diesen Fällen bestehende Parasitenpopulationen möglicherweise einem verstärkten Selektionsdruck hinsichtlich einer Resistenzentwicklung unterliegen. Bis es eindeutige, wissenschaftlich belegte Empfehlungen zur Vermeidung von bzw. den Umgang mit Resistenzen gibt, erscheint es sinnvoll, innerhalb einer Population (z. B. Haushalt, Zucht, Zwinger, Tierheim) regelmäßig und wenigstens jährlich die verwendete Wirkstoffklasse zur Bekämpfung von Flöhen und Zecken zu
wechseln. Weitere Forschungen sind notwendig.
Bei Flöhen ist die Bekämpfung von Eiern, Larven und Puppen in der Umgebung entscheidend, um den Infektionsdruck bei Tieren und Menschen zu minimieren. Dabei können Maßnahmen wie das Absaugen von Teppichen oder das Waschen (≥ 60 °C) von Schlafplatz und Decken des Tieres sinnvoll sein und zu einer Reduktion von Flohstadien in der Umgebung beitragen. Die Staubsaugerbeutel sollten in zugebundenen Plastikbeuteln über den Hausmüll entsorgt werden.
Da beim Saugen jedoch nicht alle Flohstadien vollständig erfasst werden, reicht dies als alleinige Maßnahme zur Umgebungsbehandlung, vor allem bei stärkerer Infestation, nicht aus. Bei starkem Flohbefall empfiehlt es sich daher, ergänzend zur Behandlung gegen adulte Flöhe geeignete Präparate mit direkter Wirkung gegen Entwicklungsstadien anzuwenden. Dazu stehen spezielle Produkte zur Verfügung, die entweder nur in der Umgebung einzusetzen sind (Pestizide) oder als Arzneimittel eine Zulassung für die Anwendung am Tier besitzen. Sie können Komponenten mit adultizider Wirkung und/oder einen Wachstumsregulator für Insekten (Insect Growth Regulator, IGR) enthalten.
Eine Umgebungsbehandlung im Freien gestaltet sich schwierig. Eine Möglichkeit, die Kontamination der Umgebung zu verringern, ist die Behandlung der Tiere mit einem Tierarzneimittel, das gegen juvenile Stadien wirkt bzw. die Weiterentwicklung von Eiern unterbindet.
Bei Zecken ist eine Umgebungsbehandlung weitgehend unmöglich, da die nicht auf dem Wirt befindlichen Stadien im Freien weit verbreitet sind und sich an unzugänglichen Stellen aufhalten. In Hundezwingern oder Wohnräumen, in denen eine Infestation mit z. B. R. sanguineus vorliegt, kann eine Umgebungsbehandlung sinnvoll sein. In diesen Fällen sollte ein staatlich geprüfter Schädlingsbekämpfer zu Rate gezogen werden. Die Beseitigung von Bedingungen, die sich als Unterschlupf für die nicht auf dem Wirt befindlichen Zeckenstadien eignen, kann hilfreich sein (z. B. Schließen von Spalten in
Holzböden oder Wänden).
Läuse, Haarlinge, Milben und ihre Eier können in der Umgebung und auf Gegenständen wie Bürsten oder Kämmen begrenzte Zeit überleben. Wichtig ist diese gründlich zu reinigen und darauf zu achten, dass es über solche Gegenstände nicht zu einer Übertragung von einem Tier auf das nächste oder eine Reinfektion kommt.
Um einen Befall mit Herbstgrasmilben zu vermeiden, sollten Bereiche gemieden werden in denen die Milbenlarven vorzufinden sind.
Flöhe, Zecken, Läuse, Haarlinge, Sandmücken und Stechmücken sowie Milben können verschiedene Krankheitserreger beherbergen. Einige dieser Erreger sind zoonotisch relevant. Flöhe können darüber hinaus direkt als Zoonose auf den Menschen übertragen werden.
Flöhe können leicht von Tieren auf Menschen übergehen und umgekehrt. Bei jeder Flohinfestation, vor allem in Haushalten mit kleinen Kindern, besteht darüber hinaus ein Risiko, dass sich Menschen mit Erregern infizieren, die von Flöhen übertragen werden (z. B. Bartonella spp.). Die konsequente Bekämpfung von Flöhen ist daher auch aus Gründen der öffentlichen Gesundheit von Bedeutung.
Von Zecken, die sich an einem Hund oder einer Katze festgesaugt haben, geht keine direkte Gefahr für den Menschen aus. Die von den Tieren entfernten Zecken sollten dennoch sorgfältig beseitigt werden. Gegebenenfalls können in den häuslichen Bereich eingetragene und vom Tier abgefallene Zecken den Menschen stechen.
Läuse und Haarlinge sind wirtsspezifisch. Die bei Hunden und Katzen parasitierenden Arten stellen kein gesundheitliches Risiko für den Menschen dar.
TierbesitzerInnen sollten besonders wegen des Zoonoserisikos, das von der Sarcoptes-Räude und von Cheyletiellose ausgeht, gewarnt werden. Auch Herbstgrasmilben können den Menschen befallen, allerdings ist die Infektionsquelle in der Umgebung zu sehen, während das befallene Tier als Überträger keine wesentliche Rolle spielt. Auch andere Milben (z. B. N. cati oder O. cynotis) können den Menschen vorübergehend befallen.
Wichtige präventive Maßnahmen für TierhalterInnen sind:
TierhalterInnen sollten in der Tierarztpraxis auf mögliche gesundheitliche Risiken und deren sachgerechte Prophylaxe und Bekämpfung hingewiesen werden. Insbesondere sollten sie darauf hingewiesen werden, dass das Risiko einer Infektion für immunsupprimierte und kranke Personen noch größer ist.
Das Vorgehen zur Bekämpfung von Infestationen mit Ektoparasiten sollte von der Tierärztin/dem Tierarzt mit dem Praxisteam und mit den TierhalterInnen abgesprochen werden. Die möglichen Risiken durch den Befall mit Ektoparasiten und das potenzielle Zoonoserisiko sollten durch Informationsbroschüren auch in der Humanmedizin und insbesondere bei KinderärztInnen bekannt und bewusst gemacht werden.
ÄrztInnen und TierärztInnen sollten zur Zusammenarbeit angeregt werden, und die Vorteile dieser Zusammenarbeit insbesondere im Hinblick auf potenzielle Zoonosen sollten hervorgehoben werden.
TierbesitzerInnen sollten über die möglichen Gesundheitsrisiken durch Parasitenbefall informiert werden, die nicht nur für ihre Tiere, sondern auch für Familienmitglieder und andere Menschen bestehen, die in Kontakt zu diesen Tieren kommen.
Stand: Februar 2022
© ESCCAP Deutschland
