Unsere Partner
© ESCCAP Deutschland
Einleitung
2.1. Von Zecken übertragene Erkrankungen
2.1.1. Babesiose
2.1.2. Ehrlichiose
2.1.3. Anaplasmose
2.1.4 Borreliose
2.2 Von Mücken und Sandmücken übertragene Erkrankungen
2.2.1. Leishmaniose
2.2.2. Dirofilariose und andere Filarien-Infektionen
2.3. Von Flöhen übertragene Erkrankungen
2.3.1. Bartonellose
2.4. Von Vektoren übertragene virale Erkrankungen
Durch Vektoren übertragene Krankheiten werden von zahlreichen Erregern verursacht, unter anderem durch Viren, Bakterien und Parasiten (Protozoen und Helminthen). Diese Erreger werden von diversen Arthropoden wie Zecken, Dipteren (Culiciden = Stechmücken, Phlebotomen = Sandmücken/Schmetterlingsmücken), Läusen und Flöhen übertragen. Einige der typischerweise von Vektoren übertragenen Erreger (z. B. Leishmania, Anaplasma, Babesia, Ehrlichia) können auch direkt über Blut übertragen werden, was im Rahmen von Blutspenden und -transfusionen für die tierärztliche Praxis relevant ist.
Durch Vektoren übertragene Krankheiten sind von Bedeutung, da:
Klimatische und ökologische Veränderungen können im Zusammenhang mit einem steigenden Reiseaufkommen und der Umsiedlung von Haustieren auf die epidemiologische Situation vieler Krankheiten Einfluss nehmen. So kann das Aufkommen seltener Erkrankungen in einigen Gebieten aufgrund des Importes infizierter Tiere zunehmen. Möglich ist es auch, dass sich Erreger und ihre Vektoren in bislang nicht endemische Gebiete ausbreiten und dort ansässig werden. Eine solche Ausweitung endemischer Gebiete wurde für verschiedene Erkrankungen wie die Dirofilariose, Babesiose und Leishmaniose beobachtet. Die Babesiose beispielsweise hat sich im Laufe der letzten Jahre quer durch Zentraleuropa ausgebreitet.
Durch Vektoren übertragene Krankheiten können nur kontrolliert werden, wenn ihre Vektoren gekannt und sachgerecht bekämpft werden. In dieser Empfehlung werden folgende Erkrankungen und ihre Vektoren dargestellt: Babesiose (Piroplasmose), Ehrlichiose, Anaplasmose, Borreliose, Leishmaniose, Dirofilariose, andere Filarien-Infektionen sowie die Bartonellose.
Weitere durch Vektoren übertragene Krankheiten/Erreger werden in dieser Empfehlung in den Tab. 1 a und b erwähnt, aber nicht im Detail dargestellt, z. B. Rickettsiose (z. B. Rickettsia conorii, R. slovaca, R. felis), Hepatozoonose (Hepatozoon spp.), Infektionen mit hämotrophen Mykoplasmen und Thelaziose (Thelazia callipaeda).
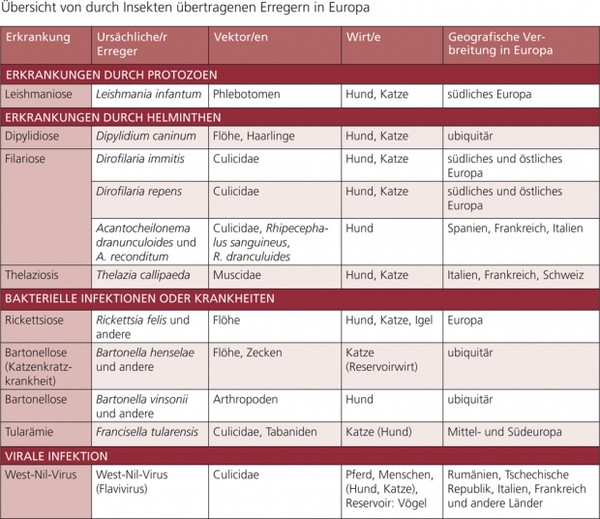
Tabelle 1a: Übersicht von durch Insekten übertragenen Erregern in Europa
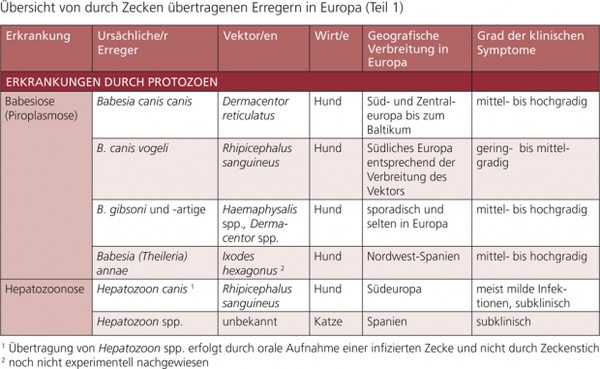
Tabelle 1b: Übersicht von durch Zecken übertragenen Erregern in Europa (Teil 1)
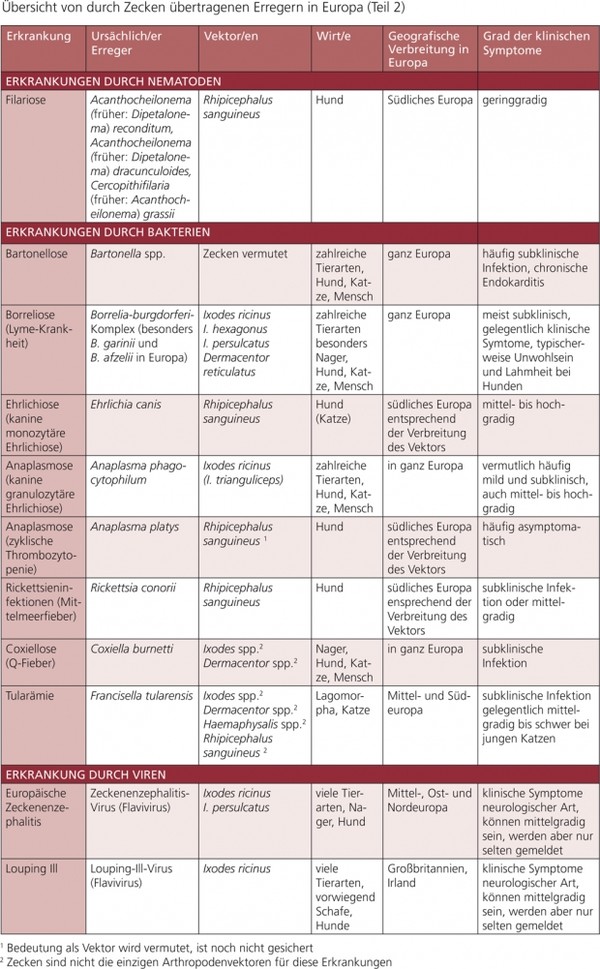
Tabelle 1b: Übersicht von durch Zecken übertragenen Erregern in Europa (Teil 2)
Erreger und Vektoren
Babesia spp. sind Haemoprotozoen, die ausschließlich Erythrozyten befallen und durch Schildzecken übertragen werden. Eine Übersicht der für Hunde und Katzen wichtigsten Spezies finden Sie in Tab. 1 b.
Biologie und Übertragung
Babesien sind bezüglich ihres Vektors und ihrer Säugetierwirte im Allgemeinen hoch wirtsspezifisch. Babesia-Stadien durchdringen in der Zecke nach oraler Aufnahme des Erregers bei einer Blutmahlzeit das Darmepithel des Vektors, vermehren sich und wandern in verschiedene Organe der Zecke, darunter Ovarien und Speicheldrüsen. Da auch eine transovariale Übertragung von infizierten adulten Weibchen auf ihre Nachkommen vorkommt, können somit auch Larvenstadien der Zecken Babesien übertragen.
Schildzecken-Weibchen müssen in der Regel zunächst 24 Stunden lang saugen, bevor Babesia-Sporozoiten in dem Speichel der Zecken für die Übertragung auf den Hund verfügbar sind. Es hat sich gezeigt, dass auch männliche Zecken Babesia spp. übertragen können, jedoch ist die epidemiologische Bedeutung männlicher Zecken bei der Übertragung noch unklar.
Die Babesien-Sporozoiten befallen im Säugetierwirt nur Erythrozyten, differenzieren sich in diesen zu Merozoiten, teilen sich mittels binärer Spaltung und führen schließlich zur Zelllyse.
Verbreitung in Europa
Endemische Gebiete der kaninen Babesiose sind an die Verbreitung der Überträgerzecken gebunden. Tab. 1 b fasst die Hautverbreitungsgebiete zusammen. Weitere Informationen siehe auch in der ESCCAP-Empfehlung Nr. 3: Bekämpfung von Ektoparasiten bei Hunden und Katzen.
Bei Katzen wird die Babesiose nur gelegentlich beobachtet.
Klinische Symptome beim Hund
Die Babesiose kann beim Hund subklinisch auftreten oder einen perakuten, akuten oder chronischen Verlauf nehmen. Weiterhin können sich verschiedene Spezies und Subspezies oder Isolate in ihrer Virulenz unterscheiden. Die Symptome richten sich nach der Virulenz des Erregers und der Schwere des Krankheitsverlaufes.
Meist ist der Verlauf akut. Nach Fieber (bis 42o C) folgen Appetitlosigkeit, Mattigkeit, Konditions- und Gewichtsverlust. Typisch sind Anämie und Ikterus, Hämoglobinurie, Bilirubinurie, evtl. Ödeme und Aszites. Möglich sind auch Blutungen in Haut und Schleimhäuten durch Thrombozytopenie und disseminierte intravasale Gerinnung sowie Nasenausfluss, Atemnot, Stomatitis, Gastritis und Myositis. Bei ZNS-Beteiligung (cerebrale Babesiose) kann es zu Paresen, epileptischen Anfällen und Bewegungsstörungen kommen. Als Folgen einer akuten Babesiose können akutes Nierenversagen und hämorrhagische Enteritis auftreten.
Bei der chronischen Babesiose zeigen die Patienten Apathie und Schwäche, Abmagerung und eine oft nur vorübergehende Erhöhung der Körpertemperatur. Eine Anämie ist meist deutlich, ein Ikterus weniger stark ausgeprägt.
Klinische Symptome bei der Katze
Aus verschiedenen Teilen der Welt, insbesondere Südafrika, wurde von Babesia-Infektionen bei Katzen berichtet. Aus Europa ist darüber wenig bekannt. Bei Katzen geht die Babesia-Infektion vor allem mit Lethargie, Anorexie, Schwäche und Durchfall einher. Die meisten an Babesiose erkrankten Katzen wiesen gleichzeitig Infektionen mit anderen Erregern (z. B. Retroviren, Mykoplasmen) auf.
Diagnose
Im Rahmen der Diagnose hat eine Differenzierung der Isolate vor allem Relevanz für die Therapie.
Mikroskopische Blutuntersuchung: Die Diagnose einer akuten Babesiose kann mit hoher Sensitivität durch die Untersuchung dünner Blutausstriche (Giemsa-Färbung oder Diff-Quick) auf intrazelluläre Babesien erfolgen. Peripheres Kapillarblut, das aus der Ohrmuschel oder Schwanzspitze entnommen wurde, enthält meist eine höhere Anzahl von mit B. canis befallenen Zellen. Bei chronischen Infektionen ist die Parasitämie sehr gering ausgeprägt, daher bedarf es hier zur Diagnosestellung oftmals einer gründlichen und langen Untersuchung der Ausstriche.
Serologie: Spezifische Antikörper sind erst ab etwa zwei Wochen nach Erstinfektion nachweisbar (IFAT, ELISA), sodass akute Infektionen noch nicht erfasst werden können. Bei Tieren, die gegen die Babesiose geimpft wurden, sind positive Ergebnisse aufgrund von Impfantikörpern nicht aussagekräftig.
Molekulare Diagnostik: Die PCR ist sensitiver als die mikroskopische Blutuntersuchung, was besonders bei der Diagnose chronischer Infektionen entscheidend sein kann. Im Rahmen einer PCR können jedoch auch falsch-negative Ergebnisse vorkommen. Mittels PCR ist ein Babesia-Nachweis zur Differenzierung der Spezies möglich. Eine Bestimmung der Babesienspezies kann für Therapie und Prognose von Bedeutung sein.
Bekämpfung: Prophylaktische Maßnahmen
Die Prophylaxe der Babesiose umfasst drei grundsätzliche Maßnahmen:
Zeckenprophylaxe – Das Risiko einer Babesien-Infektion lässt sich durch eine sachgerechte Zeckenprophylaxe reduzieren (siehe ESCCAP-Empfehlung Nr. 3: Bekämpfung von Ektoparasiten bei Hunden und Katzen).
Impfung – In einigen europäischen Ländern sind kommerzielle B.-canis-Impfstoffe verfügbar. In Deutschland stehen derzeit keine zugelassenen Impfstoffe zur Verfügung (Stand Oktober 2010, aktuelle Informationen zu Zulassungen von Impfstoffen finden Sie unter http://www.vetidata.de und auf der Website des Paul Ehrlich Institutes unter http://www.pei.de). Zur Verfügung stehende Impfstoffe verhindern zwar nicht eine Infektion, geimpfte Tiere erkranken nach einer Infektion jedoch weniger schwer.
Chemoprophylaxe – Eine Chemoprophylaxe mit einem Babesizid kann für Hunde, die sich nur vorübergehend in einem Endemiegebiet aufhalten, in Betracht gezogen werden. Im Hinblick auf die prophylaktische Alternative durch einen Zeckenschutz ist jedoch eine Risikoabwägung vorzunehmen, in der Nutzen und mögliche Nebenwirkungen gegenüberzustellen sind. Für eine Chemoprophylaxe kann Imidocarb-Diproprionat einige Stunden vor Einreise in ein endemisches Gebiet verabreicht werden (1x 5–6 mg/kg i.m. oder s.c.). Diese für ca. 4 Wochen wirkende Medikation schützt zwar nicht vor einer Infektion mit B. canis, verhindert aber eine schwerwiegende Erkrankung nach einer Infektion.
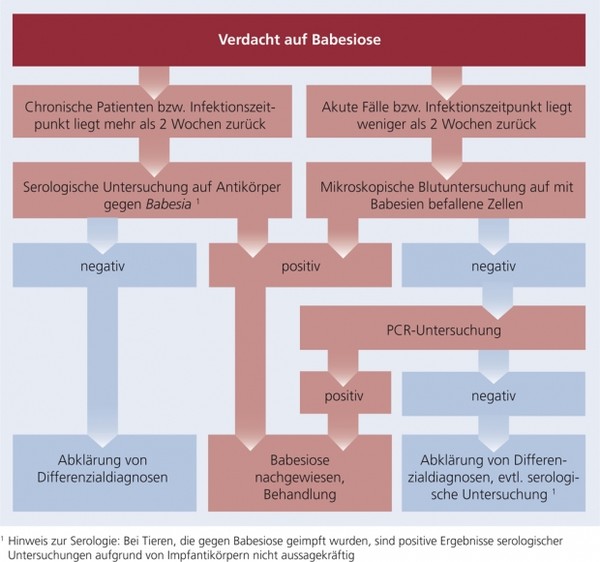
Schema 1: Diagnose der Babesiose
Chemotherapie
Eine diagnostizierte Babesiose erfordert eine unmittelbare Chemotherapie mit einem Babesizid.
Als Wirkstoff für die Therapie einer B.-canis-Infektion steht Imidocarb-Dipropionat zur Verfügung. In Deutschland ist dieser Wirkstoff nicht für die Anwendung beim Hund zugelassen, darf bei Therapienotstand aber gemäß den arzneimittelrechtlichen Bedingungen importiert werden. Ergänzend ist eine angemessene unterstützende Therapie anzuraten, die eine Rehydrierung und nötigenfalls Bluttransfusionen einschließt. Zur Therapie einer durch andere Babesien wie B. gibsoni und B. annae verursachten Babesiose sowie der Babesiose bei der Katze liegen nur wenige Informationen vor. Infektionen sind in diesen Fällen sehr schwer zu therapieren. Jedoch kann der Einsatz von Chemotherapeutika in der Regel die Schwere der klinischen Symptome auch hier verringern und Todesfälle verhindern. Geeignete Wirkstoffe und Dosierungen entnehmen Sie bitte Tab. 2.
Aspekte der öffentlichen Gesundheit
Infektionen mit Babesia canis und B.-gibsonii-artigen Babesien sind bei Menschen nicht bekannt.
Erreger und Vektoren
Ehrlichien sind vektorübertragene, gramnegative, obligat intrazelluläre Bakterien. In Europa spielt Ehrlichia canis beim Hund eine Rolle. Dieser Erreger infiziert vorwiegend Lymphozyten und Monozyten und bildet in diesen typische, lichtmikroskopisch sichtbare Mikrokolonien (Morulae).
Hauptwirt von E. canis ist der Hund. Infizierte Hunde entwickeln eine kanine monozytäre Ehrlichiose. Reservoirwirte für E. canis sind Kaniden, der Vektor ist die Zecke Rhipicephalus sanguineus. E. canis oder eine andere, eng verwandte Spezies wurden auch bei Katzen beschrieben, spielen hier jedoch in der Praxis keine relevante Rolle.
Biologie und Übertragung
Alle Stadien (Larven, Nymphen, Adulte) von R. sanguineus saugen vorzugsweise Blut von Kaniden und können E. canis von bakteriämischen Tieren aufnehmen. Der Erreger kann in infizierten Zecken überwintern. Eine transstadiale Übertragung kommt vor (von Larven auf Nymphen auf Adulte), eine transovariale Übertragung vermutlich nicht.
Während der Inkubationszeit von 8–20 Tagen vermehren sich die Erreger durch binäre Teilung in Leukozyten und Thrombozyten des Hundes, wobei sie in zirkulierenden mononukleären Zellen Morulae bilden. Anschließend verbreiten sie sich über das mononukleäre phagozytische System in Leber, Milz und Lymphknoten. Dies kann zu Thrombozytenschädigung, -sequestrierung und -zerstörung führen.
Verbreitung in Europa
Das geografische Vorkommen von Infektionen mit E. canis korrespondiert im Allgemeinen mit der Verbreitung des Vektors R. sanguineus (Abb.1).
Klinische Symptome
Hund
In der akuten Phase der kaninen monozytären Ehrlichiose, die ca. 1–3 Wochen andauert, zeigen Hunde Apathie, Depression, Anorexie, Dyspnoe, Fieber, Lymphknotenschwellungen, Splenomegalie, Petechien und Ekchymosen in Haut und Schleimhäuten, Epistaxis und Vomitus. Typisch sind ferner Thrombozytopenie, milde Leukopenie und normozytäre, normochrome, nicht regenerative Anämie.
In der subklinischen Phase, die Wochen bis Monate andauern kann, erscheinen die Hunde klinisch gesund. Typisch sind jedoch Thrombozytopenie und Hypergammaglobulinämie.
Bei der chronischen kaninen monozytären Ehrlichiose kommt es zu einem sehr komplexen klinischen Bild. Auffällig sind Schwäche, Apathie, anhaltender Gewichtsverlust, Fieber, Lymphknotenschwellungen, Splenomegalie, periphere Ödeme der Hintergliedmaßen und des Skrotums, blasse Schleimhäute, Blutungsneigung mit Ekchymosen und Petechien in Haut und Schleimhäuten, mukopurulenter Augen- und Nasenausfluss, Epistaxis und Hämaturie.
Darüber hinaus können interstitielle Pneumonien mit Dyspnoe, Nierenfunktionsstörungen, Glomerulonephritis, Arthritis, Polymyositis und Lahmheiten auftreten. Typische Veränderungen an den Augen der Patienten sind eine vordere Uveitis, Hornhauttrübungen und Hyphäma, subretinale Hämorrhagien, Netzhautablösungen und Blindheit. Bei Beteiligung des ZNS kommt es zu Nystagmus, Anzeichen einer Meningoenzephalomyelitis, Paresen, Ataxien und Konvulsionen. Typische Laborwertveränderungen sind eine Erhöhung der Leberenzymwerte Alanin-Aminotrans- ferase (ALAT) und Alkalische Phosphatase sowie Hyperproteinämie, Hypergammaglobulinämie, moderate Hypoalbuminämie, Proteinurie, Thrombozytopenie, Leukopenie und Anämie, seltener auch Panzytopenie.
Katze
Berichte über E.-canis-Infektionen bei Katzen sind selten. Klinische Manifestationen sind nicht ausreichend untersucht.
Diagnose
Zur Diagnose von Ehrlichia-Infektionen bei Hunden stehen grundsätzlich die Kombination aus einer gründlichen Anamnese zur Beurteilung eines möglichen Zeckenbefalls, die Bewertung klinischer Symptome, hämatologische und klinisch-chemische Laboruntersuchungen sowie Serologie und/oder PCR zur Verfügung.
Serologie:
PCR:
Morphologische Diagnose:
Prophylaxe
Die primäre Maßnahme zur Prävention einer Ehrlichia-Infektion ist ein effektiver Schutz gegen Zeckenbefall. Hunde, die außerhalb endemischer Gebiete leben, sollten nicht mit auf Reisen in oder durch endemische Gebiete genommen werden. Sind Aufenthalte in endemischen Gebieten unvermeidbar, so sollten angemessene Maßnahmen zur Zeckenbekämpfung ergriffen werden (siehe ESCCAP-Empfehlung Nr. 3: Bekämpfung von Ektoparasiten).
Chemotherapie
Die Therapie der kaninen Ehrlichiose setzt sich aus der Verabreichung von Wirkstoffen gegen Rickettsien und einer symptomatischen Begleittherapie zusammen. Tetrazykline sind die am häufigsten eingesetzten Wirkstoffe, wobei die tägliche Gabe von Doxyzyklin in einer Dosierung von 2 x 5 mg/kg über 3 Wochen das gängigste Behandlungsschema darstellt. Bei schweren chronischen Fällen ist die Prognose schlecht.
Aspekte des öffentlichen Gesundheitswesens
E. canis wird nicht als Zoonoseerreger angesehen.
Erreger und Vektoren
Anaplasmen sind vektorübertragene, gramnegative, obligat intrazelluläre Bakterien. In Europa werden Anaplasma phagocytophilum (früher Ehrlichia phagocytophila) und Anaplasma platys (früher Ehrlichia platys) bei Haushunden gefunden. Sie infizieren vorwiegend neutrophile und selten eosinophile Granulozyten (A. phagocytophilum) bzw. Thrombozyten (A. platys) und bilden in diesen typische, lichtmikroskopisch sichtbare Mikrokolonien (Morulae). Eine Übersicht der wichtigsten Spezies ist in Tab. 3 zusammengestellt.
Biologie und Übertragung
A. phagocytophilum
Im Ixodes-Vektor kommt es zu einer transstadialen, nicht jedoch transovarialen Übertragung von
A. phagocytophilum. Üblicherweise muss eine infizierte Zecke ca. 24–48 Stunden saugen, bevor sie den Erreger auf empfängliche Hunde überträgt. Die Inkubationszeit im Säugetierwirt beträgt 1–2 Wochen. Nach der Endozytose vermehrt sich
A. phagocytophilum durch binäre Teilung zu Morulae in den Phagosomen hauptsächlich von neutrophilen, selten auch von eosinophilen Granulozyten. Mit A. phagocytophilum infizierte Zellen kommen im zirkulierenden Blut sowie in Milz, Leber und Knochenmark vor.
A. platys
Als Vektor für die Anaplasmose wird R. sanguineus vermutet, die Bedeutung ist aber noch nicht gesichert. Nach experimentellen Infektionen dauert die Inkubationszeit 8–15 Tage. Infektionen führen zu einer zyklischen Thrombozytopenie und die höchste Bakterienlast ist während des initialen Gipfels zu finden. In nachfolgenden Zyklen ist nur etwa 1 % der Thrombozyten betroffen, während die thrombozytopenischen Episoden in etwa gleich bleiben. Mit der Zeit lässt die Schwere der thrombozytopenischen Reaktion nach.
Verbreitung in Europa
Das geografische Vorkommen von Infektionen mit Anaplasma phagocytophilum korrespondiert im Allgemeinen mit der Verbreitung des Vektors I. ricinus, der europaweit ubiquitär verbreitet ist. Ganz Europa ist daher als Endemiegebiet anzusehen.
Klinische Symptome/Laborwertveränderungen
Hund
Die Symptome einer Anaplasmose sind unspezifisch (plötzlich einsetzende Lethargie, Inappetenz/Anorexie und Fieber). Weiterhin treten Lahmheiten (Polyarthritis), blasse Schleimhäute, ein angespanntes Abdomen, Diarrhoe, Vomitus, Oberflächenblutungen, Tachypnoe, Splenomegalie und vergrößerte Lymphknoten auf. Selten sind Husten, Uveitis, Gliedmaßenödeme, Polydipsie und ZNS-Symptome. Häufigste Laborwertveränderungen sind Thrombozytopenie, Anämie, Lymphopenie, Monozytose, Leukopenie und Leukozytose, Hyperglobulinämie, Hypalbuminämie sowie erhöhte Leberenzyme.
Katze
Berichte über Anaplasma-Infektionen bei Katzen sind selten. Die wenigen bisher beschriebenen Fälle litten an Apathie, Anorexie, Fieber, Lymphadenopathie sowie Anämie und Thrombozytopenie.
Diagnose
Zur Diagnose von Anaplasma-Infektionen stehen grundsätzlich die Kombination aus einer gründlichen Anamnese zur Beurteilung eines möglichen Zeckenbefalls, die Bewertung klinischer Symptome, hämatologische und klinisch-chemische Laboruntersuchungen sowie Serologie und/oder PCR zur Verfügung.
Serologie:
PCR:
Morphologische Diagnose:
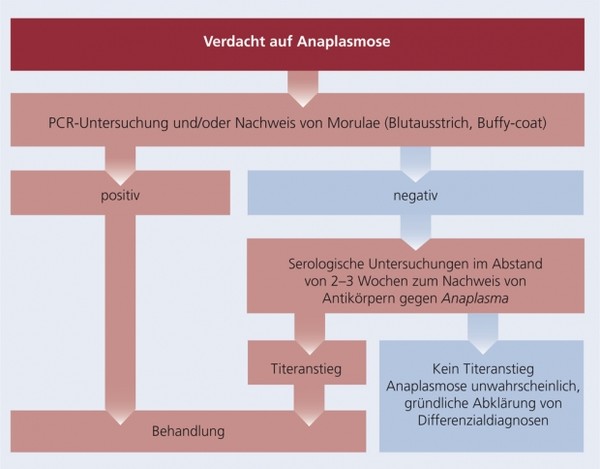
Schema 3: Diagnose der Anaplasmose
Prophylaxe
Die primäre Maßnahme zur Prävention einer Anaplasma-Infektion ist ein effektiver Schutz gegen Zeckenbefall (siehe ESCCAP-Empfehlung Nr. 3: Bekämpfung von Ektoparasiten bei Hunden und Katzen).
Chemotherapie
Die Therapie der Anaplasmose setzt sich zusammen aus der Verabreichung von Wirkstoffen gegen Rickettsien und einer symptomatischen Begleittherapie. Tetrazykline sind die am häufigsten eingesetzten Wirkstoffe, wobei die tägliche Gabe von Doxyzyklin in einer Dosierung von 2 x 5 mg/kg über 2–3 Wochen das gängigste Behandlungsschema darstellt. Die Prognose bei A.-phagocytophilum-Infektionen ist bei korrekter Therapie meist gut.
Aspekte des öffentlichen Gesundheitswesens
Es wurden Infektionen mit A. phagocytophilum beim Menschen dokumentiert. Die Übertragung hat in diesen Fällen stets über die Zecke als Vektor stattgefunden, eine direkte Anaplasma-Übertragung von infizierten Hunden auf den Menschen wurde nicht beschrieben.
Erreger und Vektoren
Aktuell gibt es 11 bekannte Spezies/Genotypen des Borrelia-burgdorferi-Komplexes (= sensu lato).
Es handelt sich um Spirochäten, die viele Säugetiere und Vögel befallen und durch Schildzecken übertragen werden. Infektionen bei Menschen sind von erheblicher klinischer Bedeutung. Bei Hunden wurden ebenfalls Infektionen nachgewiesen, die klinische Relevanz ist jedoch gering. Positive serologische Untersuchungen wurden auch bei Katzen beschrieben, über Erkrankungen bei Katzen ist aber wenig bekannt.
Biologie und Übertragung
Vektoren für B. burgdorferi sensu lato sind Zecken der Familie Ixodidae und zumeist der Gattung Ixodes.
Infizierte Zecken müssen für mindestens 16–24 Stunden saugen, bevor die Übertragung des Erregers auf einen neuen Wirt stattfinden kann.
In manchen Fällen kann es bis zu vier Wochen oder länger dauern, bis sich beim Säugetierwirt nach der Übertragung eine systemische Infektion entwickelt.
Verbreitung in Europa
Das Endemiegebiet der Borreliose ist eng an die Verbreitung von Ixodes-Zecken gebunden. Die Borreliose ist in ganz Europa endemisch.
Klinische Symptome
Beim Menschen verläuft eine Borreliose häufig mit klinischen Symptomen. Beim Hund treten jedoch in den meisten Fällen keine klinischen Symptome auf. Eine mögliche klinische Manifestation ist die „Lyme-Arthropathie“ mit Lahmheit aufgrund von Arthritis einer oder mehrerer Gelenke; vereinzelt wurden Glomerulopathien beschrieben.
Diagnose
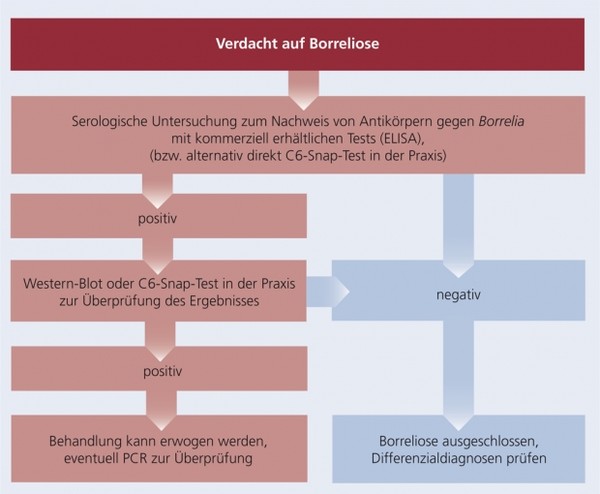
Schema 4: Diagnose der Borreliose
Prophylaxe
Die primäre Maßnahme zur Prävention einer Borrelien-Infektion ist ein effektiver Schutz gegen Zeckenbefall (siehe ESCCAP-Empfehlung 3: Bekämpfung von Ektoparasiten). Der Nutzen von Borreliose-Impfstoffen wird nach wie vor kontrovers diskutiert. Die verschiedenen zugelassenen Impfstoffe beinhalten zum Teil Antigene unterschiedlicher Spezies. Da es bisher keine zuverlässigen Studien zur speziesabhängigen Virulenz der Borrelien gibt, liegen zur vergleichenden Wirksamkeit der Vakzine bisher keine Erfahrungen vor.
Therapie
Das Antibiotikum der Wahl bei der Therapie der Borreliose ist Doxyzyklin in einer Dosis von 2 x 5 mg/kg täglich über mindestens einen Monat. Bei Patienten mit Polyarthritis sollte die Therapie innerhalb von wenigen Tagen ansprechen. Studien an experimentell infizierten Hunden haben jedoch gezeigt, dass eine antibakterielle Therapie nicht in allen Fällen die Infektion beseitigt, chronisches Trägertum ist möglich.
Aspekte des öffentlichen Gesundheitswesens
Hunde und Katzen stellen kein Reservoir für B. burgdorferi dar und sind daher für eine zoonotische Übertragung nicht von Bedeutung. Zecken, die von Hunden und Katzen abgesammelt werden, können jedoch Borrelien enthalten und diese im Einzelfall auf Menschen oder andere Wirte übertragen. Entfernte Zecken sollten daher sorgfältig entsorgt werden, um eine Übertragung auf neue Wirte zu verhindern.
Erreger und Vektoren
In Europa wird die Leishmaniose des Hundes durch das Protozoon Leishmania infantum verursacht. Vektoren sind blutsaugende Mücken der Gattung Phlebotomus (Sand-, Schmetterlingsmücken).
Der Hund gilt als Hauptwirt für L. infantum, Katzen sind seltener infiziert. Daneben können viele andere Säugetierarten, Menschen eingeschlossen, befallen werden. Auch aus Nagetieren wie Ratten und Eichhörnchen sowie aus Pferden, Rindern, Ziegen, Schafen und wilden Kaniden einschließlich Füchsen, Wölfen und Schakalen wurde L. infantum isoliert; die epidemiologische Bedeutung dieser Wirte ist noch nicht geklärt.
Adulte Sandmücken sind dämmerungs- und nachtaktiv. Im Allgemeinen beginnt die Saison für Sandmücken in endemischen Gebieten im April und hält bis November an. Die Aktivität kann jedoch von Jahr zu Jahr variieren. Sie hängt ferner von der Region sowie der Verfügbarkeit geeigneter Lebensräume für Sandmücken ab.
Phlebotomen sind im Mittelmeerraum, in Afrika und im Nahen Osten weit verbreitet und je nach Spezies gut an tropisches und subtropisches Klima und sogar aride Lebensräume angepasst. So erstreckt sich das Endemiegebiet von Phlebotomus perniciosus, einem Leishmanienvektor, bis nach Mitteleuropa. Diese Art wurde auch vereinzelt und punktuell im südlichen Deutschland und in der Südschweiz gefunden.
Biologie und Übertragung
Verbreitung in Europa
Die kanine Leishmaniose ist im südlichen Europa endemisch. Abb. 2 zeigt die ungefähre nördliche Grenze des Endemiegebietes in Europa. Nördlich dieses Gebietes wurden zahlreiche Fälle kaniner und einige Fälle feliner Leishmaniose diagnostiziert und behandelt. Hierbei handelt es sich um Patienten, die aus Endemiegebieten importiert wurden oder sich reisebegleitend in Endemiegebieten aufhielten. Es gibt vereinzelte Berichte über autochthon infizierte Hunde, die sich nie in endemischen Gebieten aufgehalten haben sollen. Ob nördlich der Alpen eine autochthone Infektion möglich ist, ist aber noch nicht zweifelsfrei erwiesen.
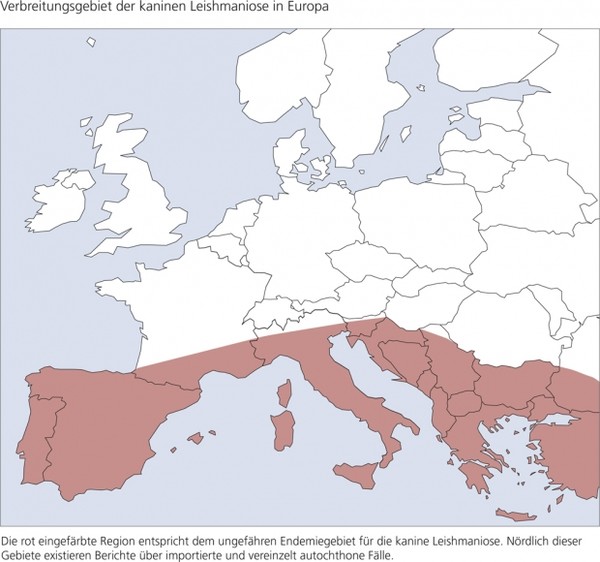
Abb. 2: Verbreitungsgebiet der kaninen Leishmaniose in Europa
Klinische Symptome
Ein Großteil der infizierten Hunde ist asymptomatisch. Treten klinische Symptome auf, können diese je nach Immunantwort und weiteren Faktoren sehr unterschiedlich sein.
Lokale kutane Läsionen im Bereich des initialen Phlebotomenstiches sind häufig das erste Anzeichen, das noch vor dem Auftreten einer disseminierten Infektion zu beobachten ist. Typische Bereiche für Phlebotomenstiche sind Ohrränder, Nase und Abdomen. Die umschriebenen, oft vorübergehenden lokalen Läsionen werden in der Regel vom Tierhalter nicht wahrgenommen. Weitere typische Anzeichen der Leishmaniose sind vergrößerte Lymphknoten, einhergehend mit Gewichtsverlust, Anorexie und Schwäche.
Ohne Therapie kann es zu schwerwiegenden klinischen Problemen kommen, die häufig zum Tod des Tieres führen. Anzeichen einer Erkrankung sind Alopezie, Hautulzera, Hyperkeratosen und ausgeprägte squamöse Dermatitiden. Generalisierte kutane Formen der Erkrankung sind üblicherweise nicht mit Juckreiz verbunden, symmetrisch und meistens kerato-seborrhoeisch, können aber auch ulzerös, papulär, pustulär oder nodulär sein.
Allgemeinsymptome wie Muskelatrophie, Splenomegalie, Epistaxis, Hämaturie und (hämorrhagische) Enteritis wurden ebenfalls beschrieben. Ferner können Polyarthritis, Glomerulonephritis, Meningitis und Augenveränderungen wie z. B. Uveitis auftreten.
Häufige labordiagnostische Befunde sind eine normozytäre normochrome nicht regenerative Anämie sowie Thrombozytopenie, Hyperglobulinämie und Hypoalbuminämie, Proteinurie und eine Azotämie mit einer Steigerung der Urin-Protein/Kreatinin-Ratio.
Diagnose
Die Schemata 5 a und b fassen die Empfehlungen zum diagnostischen Vorgehen bei klinisch gesunden Hunden nach Aufenthalt in endemischen Gebieten und bei Hunden mit Leishmaniose-typischen klinischen Symptomen bzw. Organinsuffizienzen übersichtlich zusammen.
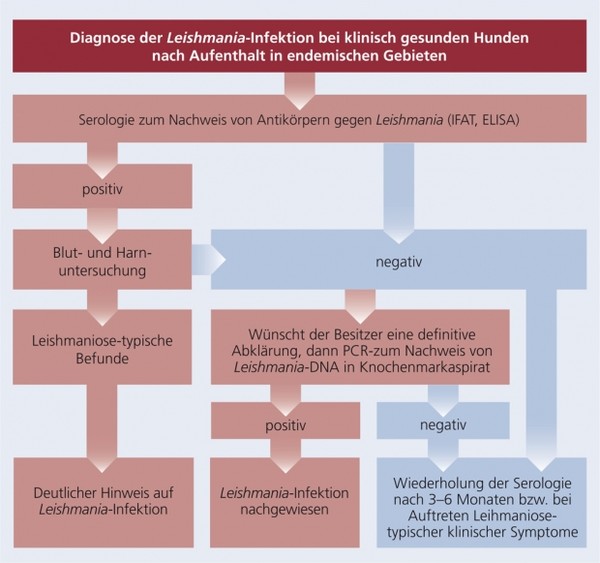
Schema 5a: Diagnose der Leishmania-Infektion bei klinisch gesunden Hunden nach Aufenthalt in endemischen Gebieten
Prophylaxe
Prophylaktische Maßnahmen gegen Stiche der Sandmücken werden empfohlen, um das Risiko einer Übertragung des Leishmanioseerregers zu verringern. Dazu gehören auch Maßnahmen, die eine Exposition von Hunden gegenüber Sandmücken minimieren. So sollten in Deutschland gehaltene Hunde nicht in Regionen mitgenommen werden, in denen die Leishmaniose endemisch vorkommt. Lässt sich dies nicht vermeiden, sollten die Tiere vor Ort nach Einbruch der Abenddämmerung im Haus gehalten werden. Fenster und Türen von Räumen, in denen Hunde untergebracht sind, sollten mit engmaschigen Mückennetzen gesichert werden. Darüber hinaus wird der Einsatz von Insektiziden mit repellierender Wirkung gegen Phlebotomen empfohlen. Die regelmäßige Applikation dieser Wirkstoffe während der gesamten Saison der Sandmücken kann das Risiko einer Infektion mit
L. infantum signifikant verringern.
HINWEIS:
Aktuell ist in Deutschland ein Leishmania infantum-Impfstoff zugelassen und verfügbar. Dieser besteht aus einem rekombinant hergestellten Protein, das aus der Verbindung von fünf antigenen Fragmenten von vier Proteinen des Parasiten Leishmania infantum besteht. Dieser Impfstoff kann seronegativen Hunden, die älter als sechs Monate sind, als einmalige Erstinjektion verabreicht werden, gefolgt von einer jährlichen Auffrischungsimpfung. Der Impfstoff ist angezeigt zur Verringerung des Risikos einer aktiven Infektion, einer klinischen Erkrankung oder beidem nach einer Exposition gegenüber L. infantum. Der neue Impfstoff beeinträchtigt nicht den Nachweis von Anti-L.-infantum-Antikörpern und ermöglicht so die Unterscheidung von geimpften von natürlich infizierten Hunden.
Resistenzen gegen Insektizide und Repellentien:
Es liegen bei Phlebotomen keine Berichte über Resistenzen gegen Pyrethroide vor.
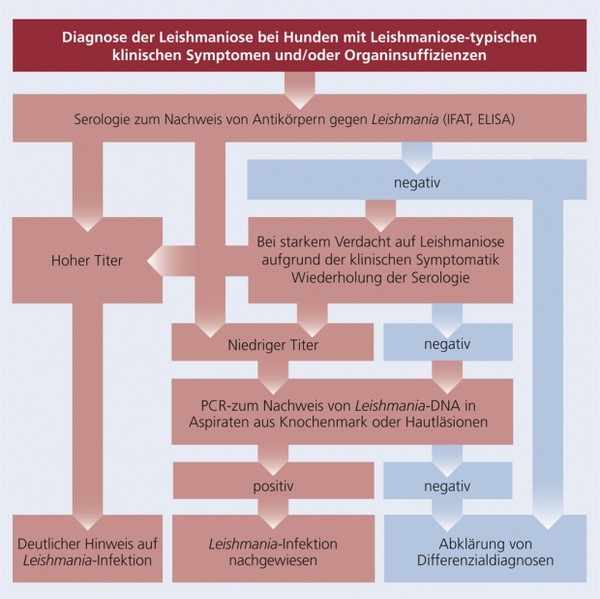
Schema 5b: Diagnose der Leishmaniose bei Hunden mit Leishmaniose-typischen klinischen Symptomen und/oder Organinsuffizienzen
Chemotherapie
Vor der Einleitung einer Therapie sollten die Besitzer über Prognose, Kosten der Behandlung und die Tatsache aufgeklärt werden, dass der Hund auch nach einer Therapie und klinischer Besserung infiziert bleiben wird und mit Rezidiven gerechnet werden muss. Eine Übersicht zur Chemotherapie und Therapeutika sowie deren Dosierung ist in Tab. 4 zusammengestellt.
Indikation für eine Therapie von Leishmania-infizierten Hunden in Deutschland sind klinische Symptome oder Leishmaniose-typische Organinsuffizienzen kombiniert mit dem Nachweis einer Leishmania-Infektion. Symptomfreie Hunde ohne Organinsuffizienzen sollten nicht behandelt werden. Empfohlene Wirkstoffe, Dosierungen und Anwendungsdauern für die Behandlung der kaninen Leishmaniose sind in Tab. 4 aufgeführt.
Für die Therapie der kaninen Leishmaniose steht N-Methylglucamin-Antimonat ggf. in Kombination mit Allopurinol zur Verfügung. Die wiederholte intramuskuläre Injektion dieses Wirkstoffes kann schmerzhafte ödematöse Reaktionen zur Folge haben und wird daher nicht empfohlen, die Alternative der subkutanen Injektion sollte vorgezogen werden.
In den vergangenen Jahren wurden in Spanien, Frankreich und Italien verschiedene klinische Studien mit Miltefosin, einem neuen Alkylphospholipid, durchgeführt. Dieser Wirkstoff wurde bei Hunden mit natürlicher L.-infantum-Infektion getestet und wies eine therapeutische Wirksamkeit auf, die vergleichbar mit jener von Antimonpräparaten war. Nebenwirkungen wie Erbrechen, Diarrhoe und Anorexie in unterschiedlicher Ausprägung wurden beschrieben, ließen sich aber vermeiden bzw. reduzieren, wenn das Mittel mit dem Futter verabreicht wurde. Über die Rezidivrate ist bei Einsatz dieses Wirkstoffes noch wenig bekannt.
Allopurinol kann als Monotherapie und in Kombination mit oben genannten Therapeutika eingesetzt werden und wird üblicherweise 2–3 x täglich in einer Tagesdosis von 10–20 mg/kg Körpergewicht oral über 6–18 Monate verabreicht.
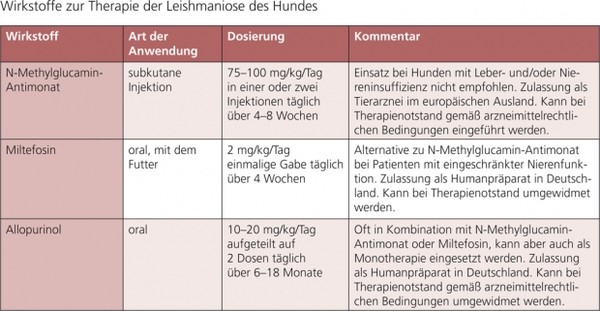
Tabelle 4: Wirkstoffe zur Therapie der Leishmaniose des Hundes
Eine Besserung der klinischen Symptome tritt meistens innerhalb weniger Wochen nach Beginn der Chemotherapie ein, ein vollständiges Abklingen der Symptome wird jedoch erst nach mehreren Monaten erreicht. Sollte nach einer Behandlung innerhalb der ersten Monate keine Besserung eintreten, muss das Therapieschema neu überdacht werden. In solchen Fällen ist die Diagnose kritisch zu hinterfragen, mögliche Begleiterkrankungen wie Ehrlichiose, Babesiose, Hepatozoonose oder eine Immunsuppression müssen differenzialdiagnostisch abgeklärt werden.
Da die Leishmanien-Infektion durch die Behandlung mit den momentan verfügbaren Wirkstoffen nicht eliminiert wird, sind Rezidive häufig. Erste Hinweise auf ein Rezidiv sind Hypoalbuminämie/Hyperglobulinämie, kombiniert mit einem Anstieg spezifischer Antikörper in zwei aufeinander folgenden Proben, die im Abstand von mehreren Monaten im selben Labor untersucht wurden.
Ist eine klinische Heilung einschließlich Normalisierung der Blutparameter erzielt worden, ist es ratsam, die Behandlung abzusetzen und die Hunde nach drei Monaten und anschließend in sechsmonatigen Intervallen zu überwachen.
Neben der spezifischen Therapie sollte eine symptomatische Behandlung erfolgen. Empfohlen wird unter anderem eine Diätnahrung, die einen mäßigen Proteingehalt aufweist und mit Omegafettsäuren, Zinksulfat und Antioxidantien angereichert ist.
In vitro wurden Resistenzen gegen N-Methylglucamin-Antimonat beobachtet, gegen die anderen empfohlenen Wirkstoffe sind keine Resistenzen bekannt.
Aspekte des öffentlichen Gesundheitswesens
Im südlichen Europa ist die durch L. infantum verursachte humane viszerale Leishmaniose eine durch Vektoren übertragene Zoonose. Klinische Fälle humaner Leishmaniose enden ohne Therapie oft tödlich, besonders bei Kindern und immunsupprimierten Patienten. Immunkompetente erwachsene Patienten sind jedoch immunologisch geschützt, sodass die Erkrankung bei ihnen nicht ausbricht.
Erreger und Vektoren
Diese Empfehlung beinhaltet nur Filarien, deren Hauptwirte Hunde und Katzen sind. Filarien sind Nematoden, die das Bindegewebe oder das Gefäßsystem befallen. Die meisten Spezies werden durch Mücken, einige durch Flöhe oder Zecken übertragen (siehe Tab. 5). Dirofilaria immitis, der kanine und feline Herzwurm, ist die virulenteste Filarienart und kann zu schweren klinischen Erkrankungen führen. Dirofilaria repens verursacht meist symptomlose, subkutane Infektionen; diese Spezies ist jedoch als Zoonose-Erreger in Europa von besonderer Bedeutung. Beide Erreger werden durch Stechmücken übertragen.
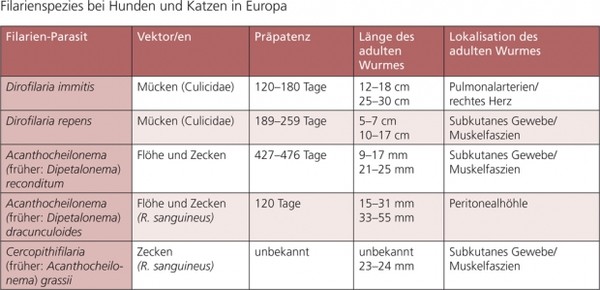
Tabelle 5: Filarienspezies bei Hunden und Katzen in Europa
Biologie und Übertragung
Für beide Dirofilaria-Arten sind in Europa Stechmücken der Gattungen Culex, Aedes und Anopheles kompetente Zwischenwirte und Vektoren.
Aufgrund der geringen Wirtsspezifität ihrer Vektoren können die hier besprochenen Filarien nicht nur Hunde und Katzen, sondern auch andere Säugetierwirte und den Menschen infizieren. In solchen Fehlwirten entwickelt sich der Parasit meistens nicht bis zum adulten Stadium.
Bei D. immitis und D. repens entwickeln sich die als Mikrofilarien bezeichneten Erstlarven im Uterus der Nematoden-Weibchen und werden von diesen in die Blutbahn des Wirtes abgegeben, wo sie für blutsaugende Stechmücken zugänglich werden. In der Mücke entwickeln sich die Mikrofilarien zu infektiösen dritten Larvenstadien, die bei einer folgenden Blutmahlzeit auf einen anderen Wirt übertragen werden.
D.-immitis-Larven gelangen im Wirt nach ausgedehnter Wanderung durch verschiedene Gewebe, schließlich in die Lungenarterien oder die rechte Herzhälfte, wo sie sich zu adulten Würmern entwickeln und verpaaren. In Hunden können adulte Herzwürmer bis zu 7 Jahren, Mikrofilarien 2–18 Monate in der Blutbahn überleben.
D.-repens-Larven wandern nur kurze Strecken in subkutanem Bindegewebe und reifen dort zu Adultstadien heran. Diese finden sich dann in kleinen Knoten zwischen subkutanen und tiefen Bindegewebsschichten und können dort mehrere Jahre leben.
Verbreitung in Europa
Das Vorkommen sowie die Übertragungshäufigkeit und Ausbreitung von Dirofilaria spp. ist von Umweltfaktoren wie Temperatur und Dichte der Vektorenpopulation abhängig. Weitere Faktoren sind die Dichte der Hundepopulation sowie der Transport mikrofilarämischer Hunde durch Tourismus oder Umsiedelung aus endemischen in nicht endemische Gebiete. Abb. 3 gibt einen Überblick über die endemischen Gebiete von D. immitis und D. repens in Europa.
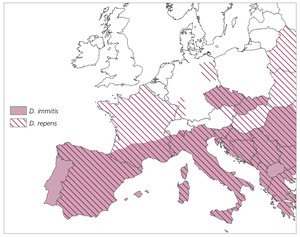
Abb. 3: Endemische Gebiete für D. immitis und D. repens in Europa
In letzter Zeit wurden D.-repens-Infektionen auch bei Hunden diagnostiziert, die nach Angaben ihrer Halter niemals Deutschland, die Niederlande oder Österreich verlassen hatten, was auf autochthone Infektionen hindeutet und ein zumindest geringes Vorkommen auch in diesen Ländern voraussetzt.
Infektionen mit Dirofilarien kommen auch bei Katzen vor. D.-immitis-Infektionen treten vor allem in Gegenden mit einer hohen Prävalenz kaniner Dirofilariose auf (z. B. in Norditalien).
Klinische Symptome
D.-immitis-Infektion
Die Infektion mit D. immitis kann zu einer schweren und potenziell tödlichen Erkrankung bei Hunden und Katzen führen. Adulte Herzwürmer überleben im Hund 5–7 Jahre. Obwohl die Bezeichnung „Herzwurmerkrankung“ eine primär kardiale Lokalisation andeutet, handelt es sich hauptsächlich um eine pulmonale Erkrankung, denn die Hauptlokalisation der adulten Stadien sowie die daraus entstehenden Schäden liegen in den Pulmonalarterien, das Herz ist erst in einem späteren Stadium involviert. Gelegentlich parasitieren adulte Stadien jedoch auch im rechten Herz und angrenzenden großen Gefäßen wie der vorderen und hinteren Hohlvene. Ektopische Lokalisationen in Gehirn, Augen, Hoden oder der Aorta kommen selten und eher bei Katzen vor.
Während des chronischen Verlaufes können plötzlich akute Symptome auftreten. Beispielsweise können Hunde als Folge schwerer spontaner Thrombembolien durch das zeitgleiche natürliche Absterben vieler Herzwürmer akute lebensbedrohende Dyspnoe und Hämoptyse zeigen. Bei kleinen Hunden kommt es aufgrund des pulmonalen Hochdrucks und des plötzlichen Abfalls des Auswurfvolumens des rechten Herzens häufig zur Verlagerung adulter Würmer von den Pulmonalarterien in die rechte Herzhälfte. In diesem Fall zeigen die Hunde das so genannte „Vena-cava-Syndrom“. Dyspnoe, ein Trikuspidalisgeräusch und Hämoglobinurie durch mechanische Hämolyse in den rechten Herzkammern sind typische Anzeichen. Der Ausgang dieser schweren Verlaufsform ist meist letal.
Feline D.-mmitis-Infektion
Der klinische Verlauf der Dirofilariose bei der Katze unterscheidet sich erheblich von jenem beim Hund. Die meisten Katzen zeigen ebenfalls über längere Zeit nach Infektion keine klinischen Symptome. Die Infektion bei Katzen ist gekennzeichnet durch eine relativ geringe Wurmbürde (2–4 adulte Würmer), eine längere Präpatenz (8 Monate), ein geringes Ausmaß und eine kurze Dauer der Mikrofilarämie sowie eine kürzere Lebenserwartung der adulten Würmer (maximal 2 Jahre).
Durch natürliches Absterben der Parasiten kann es alternativ zu einer Spontanheilung oder einem plötzlich akuten Krankheitsverlauf kommen. Dieser ist vorwiegend mit respiratorischen Symptomen wie Husten, Dyspnoe und Hämoptyse verbunden. Auch Erbrechen wird häufig beobachtet. Nicht selten treten plötzliche Todesfälle bei zuvor scheinbar gesunden Katzen auf.
Ein chronischer Verlauf ist häufig mit Husten, Erbrechen, Diarrhoe und Gewichtsverlust verbunden. Anders als beim Hund werden Symptome, die von einer Rechtsherzinsuffizienz ausgehen, bei der Katze nicht als typisch für eine Herzwurm-Infektion erachtet.
D.-repens-Infektion
Eine D.-repens-Infektion ist meistens ein Zufallsbefund bei Operationen in subkutanen Geweben, in perimuskulären Faszien, in perirenalem Fettgewebe oder in der Bauchhöhle. D. repens kann bei Hunden und Katzen die Bildung subkutaner schmerzloser, verschiebbarer Knoten verursachen, die adulte Parasiten und Mikrofilarien enthalten. In Einzelfällen konnte eine noduläre Konjunktivitis nachgewiesen werden. Bei Hunden sind selten auch pustuläre Ausschläge, ulzeröse Läsionen und Skabies-artige Dermatitiden in der Haut zu beobachten.
Andere Filarien bei Hunden und Katzen: Infektionen mit A. reconditum, A. dracunculoides und Cercopithifilaria grassii verlaufen in der Regel symptomlos. Einige Fälle von Dermatitis, Pruritus und Mikrogranulomen wurden bei Hunden im Zusammenhang mit einer patenten (mikrofilarämischen) A.-dracunculoides-Infektion beobachtet.
Besonderheit: Wolbachia-Filarien-Symbiose
Wolbachien sind gram-negative Bakterien der Gattung Wolbachia. Sie leben endosymbiontisch in Filarien und haben im Laufe der Evolution essenzielle Stoffwechselfunktionen für diese übernommen. Für die Pathogenese und Immunologie der Herzwurm-Infektion spielen sie eine entscheidende Rolle. Im Rahmen der Therapie einer Dirofilariose können Wolbachien durch eine antibiotische Therapie bekämpft werden. Eine Behandlung mit Tetrazyklinen oder deren synthetischen Derivaten kann die Wolbachien-Population in den Würmern drastisch reduzieren, wenn auch nicht vollständig eliminieren. Die antibiotische Therapie hat einen adultiziden Effekt und führt gleichzeitig zur Unfruchtbarkeit weiblicher Würmer.
Diagnostisches Vorgehen beim Hund
Eine Herzwurm-Infektion kann durch Nachweis von Mikrofilarien im Vollblut oder von zirkulierendem Antigen adulter Würmer im Plasma oder Serum diagnostiziert werden. Mikrofilarien können in spezialisierten Labors mittels Saure-Phosphatase-Färbung oder durch molekulare Verfahren (PCR) differenziert werden (siehe Schema 6).
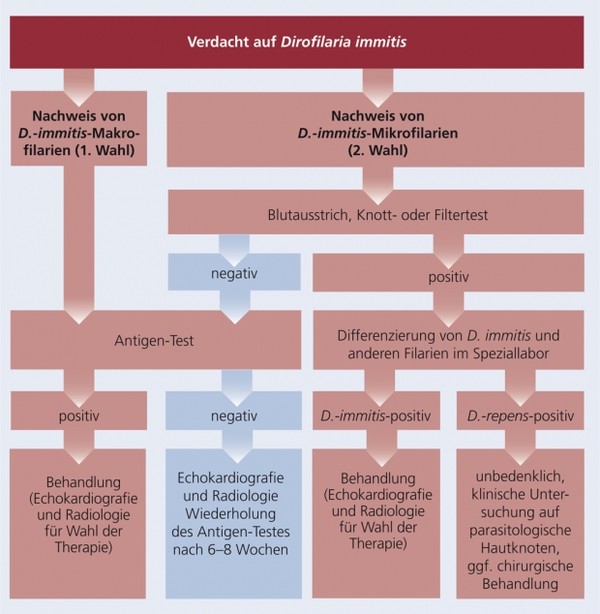
Schema 6: Diagnose von Dirofilaria immitis und anderen Filarienarten beim Hund
Diagnostisches Vorgehen bei der Katze
Prophylaxe
Grundsätzlich ist davon abzuraten, Hunde oder Katzen auf Reisen in endemische Regionen mitzunehmen. Gegenwärtig gibt es keine Repellenzien/Insektizide, die laut Zulassung nachweislich eine Übertragung von Herzwürmern vollständig verhindern können, sie können aber den Mückenanflug zu einem großen Maße reduzieren. Die Bekämpfung der Dirofilariose konzentriert sich daher auf die Anwendung makrozyklischer Laktone, die wandernde Larven abtöten, bevor diese ihren endgültigen Ansiedlungsort erreichen. Auf diese Weise kann zwar eine Infektion nicht verhindert werden, aber zumindest ein Befall mit adulten Herzwürmern. Alle derzeit in Deutschland gegen D. immitis zugelassenen Produkte sind für eine monatliche Anwendung vorgesehen. Die Behandlung mit diesen Produkten sollte daher innerhalb der ersten vier Wochen nach Beginn einer möglichen Übertragung starten und bis 30 Tage nach der zuletzt möglichen Übertragung in monatlichen Abständen fortgesetzt werden.
Therapie einer nachgewiesenen D.-immitis-Infektion beim Hund
Das Therapieschema setzt sich aus verschiedenen Maßnahmen zusammen und richtet sich nach dem Komplikationsrisiko. Vor der Behandlung muss der Schweregrad der Infektion abgeschätzt werden. Das wichtigste Kriterium hierfür sind radiologisch erkennbare Lungenveränderungen. Sind diese hochgradig, sollte das Ausmaß der pulmonären Hypertonie echokardiografisch quantifiziert werden. Die Behandlungsempfehlungen im Einzelnen sind:
Bei asymptomatischen Patienten mit leichten Infektionen ohne radiologische Veränderungen wird eine 2-malige Injektion von Melarsamin (2,5 mg/kg i. m. im Abstand von 24 h) vorgenommen. Auch hier sind 2 Wochen strikte Bewegungseinschränkung (Boxenruhe) einzuhalten, anschließend erhält der Patient über 2 Wochen strikten Leinenzwang.
Eine chirurgische Entfernung adulter Würmer ist indiziert, wenn sich viele Würmer in die rechte Herzkammer verlagert haben und schwere klinische Symptome (Vena-Cava-Syndrom) verursachen. Dies kann unter Vollnarkose mithilfe einer flexiblen Fasszange erfolgen, die über die Jugularvene unter Ultraschall eingeführt wird. Hiermit können nicht nur die rechten Herzkammern, sondern auch die großen Lungengefäße erreicht werden. Bei hochgradig infizierten Hunden reduziert das Entfernen möglichst vieler Würmer das Risiko einer Thromboembolie.
Therapie einer nachgewiesenen D.-immitis-Infektion bei der Katze
Eine adultizide Therapie wird bei Katzen wegen des hohen Risikos von schweren Thromboembolien und plötzlicher Todesfälle nach der Behandlung generell nicht empfohlen. Soll sie dennoch durchgeführt werden, wird zusätzlich Prednisolon in abnehmenden Dosen mit einer Initialdosis von 2 mg/kg täglich empfohlen, um respiratorische Symptome zu mildern. Zeigt eine Katze aufgrund einer Embolie durch abgestorbene Würmer schwerwiegende Symptome, wird eine höhere Dosierung des Prednisolons empfohlen (1–2 mg/kg dreimal täglich).
Therapie einer nachgewiesenen D.-repens-Infektion bei Hund und Katze
Für D.-repens-Infektionen ist keine effektive Therapie bekannt. Da die meisten Infektionen klinisch unauffällig sind, wird keine Therapie empfohlen. Ein Einsatz von makrozyklischen Laktonen reduziert die Infektion und ist möglich, um das Zoonoserisiko zu verringern. Parasitäre Knoten können chirurgisch entfernt werden.
Aspekte des öffentlichen Gesundheitswesens/zoonotische Bedeutung
In Europa ist D. repens der häufigste Erreger der humanen Filarien-Infektion, vereinzelt wurden auch Lungenknoten durch D. immitis verursacht. Die meisten Fälle verlaufen asymptomatisch und bedürfen keiner Therapie; in vielen Fällen wurde die Infektion erst nach der chirurgischen Entfernung eines Knotens, der Würmer enthielt, diagnostiziert. Neben dem klassischen Bild solitärer Lungenknoten wurden auch Fälle von Lokalisationen im Auge und in tiefen Körpergeweben berichtet, die gelegentlich einen Tumor vortäuschen.
Erreger und Vektoren
Die wichtigste Spezies, auf die diese Empfehlung Bezug nimmt, ist das Bakterium Bartonella henselae. B. henselae ist als Erreger der Katzenkratzkrankheit (Cat Scratch Disease, CSD) des
Menschen relevant. Katzen werden als Hauptreservoir, u.a. für B. henselae und B. clarridgeiae,
angesehen. Vektor für viele Bartonella-Arten, insbesondere von B. henselae, sind Flöhe, vor allem der Katzenfloh Ctenocephalides felis felis. Bartonella spp. konnten auch in anderen blutsaugenden Arthropoden wie Zecken oder Stechfliegen festgestellt werden. Inwieweit diese Parasiten eine Rolle bei der Übertragung spielen, ist bislang ungeklärt. Bei der großen Mehrheit von Personen mit
Katzenkratzkrankheit, bazillärer Peliosis oder bazillärer Angiomatose wurden B. henselae oder
B. quintana als Erreger nachgewiesen. Auf der Grundlage serologischer Untersuchungen wurde
auch B. clarridgeiae als Ursache von Erkrankungen ähnlich der Katzenkratzkrankheit vermutet.
Biologie und Übertragung
Bartonellen sind hämotrophe Bakterien, die fakultativ intrazellulär in Erythrozyten und Endothelzellen parasitieren. Der Erreger konnte bei Katzen in Blut- sowie in Krallen- und Speichelproben nachgewiesen werden. Wie die Übertragung von B. henselae genau stattfindet, ist noch nicht bis ins Detail geklärt. Entscheidend für die Infektion ist aber sowohl der Kontakt zu Flöhen als auch zu deren Kot. Im Kot infizierter Flöhe kann der Erreger bis zu neun Tage überleben und infektiös bleiben. Für die Infektion des Menschen spielen Kratz- und Bisswunden durch Katzen eine entscheidende Rolle. Es wird vermutet, dass Maulhöhle und Krallen infizierter Katzen bei der Fellpflege mit erregerhaltigem Flohkot kontaminiert werden und der Erreger über Hautwunden auf den Menschen übertragen wird. Ein weiterer Übertragungsweg ist die iatrogene Transmission im Rahmen von Bluttransfusionen.
Verbreitung in Europa
Der Erreger B. henselae sowie der primäre Vektor Ctenocephalides felis felis sind weltweit verbreitet. Die höchste Wahrscheinlichkeit für eine Infektion mit Bartonellen besteht bei Katzen unter zwei Jahren, Katzen mit Freigang, Streunern und Tieren in Mehrkatzenhaushalten. Der Bartonella-Nachweis variiert je nach Katzenpopulation und ist von der diagnostischen Methode abhängig.
Klinische Symptome
Die meisten Infektionen mit Bartonella spp. bei Katzen bleiben asymptomatisch. Es kommt in der Regel zu einer Bakteriämie, die erstmals ein bis drei Wochen nach der Infektion auftritt und bis zu
21 Monate chronisch rezidiviert. Klinische Symptome treten nur bei immunsupprimierten Katzen auf. Diese zeigen dann evtl. Fieber, Lymphadenopathie, Gingivitis, Uveitis und Endokarditis, auch transiente Anämien und persistierende Eosinophilien sind beschrieben. Ein Zusammenhang mit Erkrankungen der ableitenden Harnwege sowie mit verminderten Reproduktionsleistungen wurde ebenfalls dargestellt.
Diagnose
Folgende diagnostische Vorgehensweise wird empfohlen:
Prophylaxe
Die primäre Maßnahme zur Prävention einer Bartonella-spp.-Infektion ist ein effektiver Schutz gegen Flohbefall sowie eine umgehende Flohbehandlung befallener Tiere und gute Hygiene bei Flohbefall zur Minimierung von Flohkot auf dem Tier und in seiner Umgebung (siehe ESCCAP-Empfehlung
Nr. 3: Bekämpfung von Ektoparasiten bei Hunden und Katzen).
In Haushalten mit immunsupprimierten Personen sind besondere Vorsichtsmaßnahmen einzuhalten.
Chemotherapie
Die Therapie der Bartonellose vermag mit derzeit zur Verfügung stehenden Wirkstoffen lediglich die Bakteriämie zu reduzieren, nicht aber den Erreger zu eliminieren. Eine Behandlung wird daher nur bei Katzen empfohlen, die klinische Symptome zeigen und/oder mit immunsupprimierten Menschen Kontakt haben.
Mögliche Therapiemaßnahmen:
Spricht das Tier auf die Therapie an, sollte sie mindestens 28 Tage bzw. bis 2 Wochen nach Ab klingen der Symptome fortgeführt werden.
Auch hier gilt, dass die Therapie bis zu zwei Wochen nach dem Abklingen der Symptome fortgeführt werden soll.
Aspekte des öffentlichen Gesundheitswesens/Zoonose
Die Übertragung auf den Menschen erfolgt durch den Kontakt zu meist subklinisch infizierten Katzen in der Regel über Kratz- oder Bissverletzungen. Auch eine Übertragung über Flohkot, der mit Hautverletzungen in Kontakt kommt, ist möglich. Ob eine Übertragung auf den Menschen direkt über den Katzenfloh stattfinden kann, ist unklar.
Eine Infektion mit B. henselae führt auch beim Menschen nicht immer zu einer Erkrankung. Falls doch, unterscheidet sich deren Ausprägung bei immunkompetenten und immunsupprimierten Patienten erheblich. Immunkompetente Personen erkranken in der Regel an der klassischen Form der Katzenkratzkrankheit (Cat Scratch Disease, CSD) mit Pustelbildung an der Infektionsstelle, regionaler Lymphadenopathie, Abszessbildung und eventuell Fieber. Die meisten Fälle von unkomplizierter CSD sind selbst limitierend, können sich aber bis zur kompletten Ausheilung über Monate hinziehen. Diese Formen reagieren nur minimal oder gar nicht auf eine antimikrobielle Therapie.
Bei immunsupprimierten Personen kommt es zu wesentlich komplizierteren Verläufen. Es können sich eine bazilläre Peliosis, eine bazilläre Angiomatose, Endokarditiden, Retinitiden und Enzephalopathien entwickeln. In diesen Fällen ist eine antimikrobielle Therapie wirksam und angezeigt.
Von Vektoren bei Hunden und Katzen übertragene virale Infektionen sind für die Kleintierpraxis nicht relevant. Der Übersicht halber sind die wichtigsten Fakten dazu in den Tab. 6 a, b und c zusammengefasst.
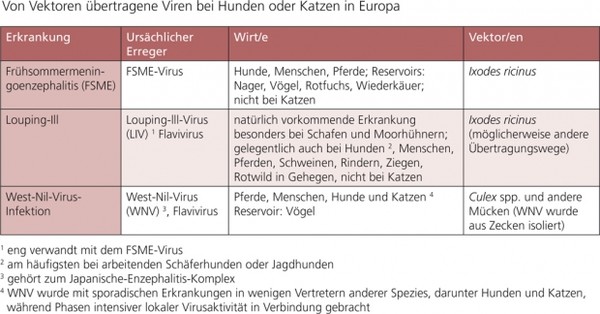
Tabelle 6a: Von Vektoren übertragene Viren bei Hunden oder Katzen in Europa
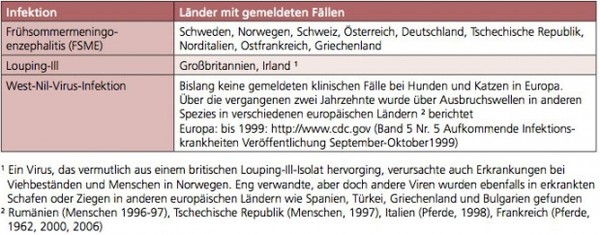
Tabelle 6b: Verbreitung von durch Vektoren übertragenen Virusinfektionen bei Hunden und Katzen in Europa

Tabelle 6c: Klinische Manifestationen bei von Vektoren übertragenen Virusinfektionen bei Hunden
Stand: April 2011
© ESCCAP Deutschland
